Артемизинин: загадочное лекарство, пришедшее из китайской традиционной медицины
Авторы:
- Джиганг Ванг,
- Чхенгькао Ксю,
- Йин Кван Вонг,
- Юйи Ли,
- Фулонг Лиао,
- Тинглианг Джианг,
- Юю Ту.
Учебные заведения:
- Академия Китайских Медицинских Наук, Центр Исследования Артемизинина, Бейинг, 100700, Китай
- Академия Китайских Медицинских Наук, Институт Китайской Медицинской Материи, Бейинг 100700, Китай
- Национальный Университет Сингапура, Медицинская школа Йонга Лу Лина, кафедра фармакологии, Сингапур (город) 117600, Сингапур (страна)
- Национальный Университет Сингапура, Медицинская школа Йонга Лу Лина, кафедра физиологии Сингапур (город) 117597, Сингапур (страна)
История статьи:
- Получена 8 июня 2018
- Отредактирована 1 августа 2018
- Принята 12 ноября 2018
- Доступна онлайн с 18 декабря 2018
Ключевые слова:
- Артемизинин
- Механизмы взаимодействия с возбудителями малярии.
- Противо-раковое действие
Преамбула:
Артемизинин и его производные представляют собой наиболее важный и действенный класс лекарств среди средств борьбы с малярией. Со времени открытия артемизинина в начале 1970-х годов мировое сообщество добилось больших успехов в характеристике и понимании этого замечательного фитохимического и его уникальных химических и фармакологических свойств. Сегодня, даже несмотря на то, что артемизинин продолжает служить основой для противомалярийной терапии, возникли многочисленные проблемы в продолжающемся применении и разработке этого семейства лекарств. Эти проблемы включают появление отсроченных ответных реакций на лечение артемизининами при малярии и увеличене количества случаев применения артемизининов по показаниям, не связанным с малярией. Здесь мы даем обзор истории артемизинина с точки зрения его прошлого, настоящего и будущего. В частности, мы комментируем современное понимание механизма действия (МОА) артемизининов и подчеркиваем важность связи механистических исследований с терапевтическими исходами как в малярийном, так и в немалярийном контекстах.
Введение
Артемизинин (и его различные производные, которые мы будем называть «артемизинином», (если не указано иное) – это сесквитерпеновое соединение компонента лактона (рис. 1) с уникальной химической структурой, полученной из растения сладкой полыни , Artemisia annua L. (рис. 2). С момента своего открытия он стал самым важным и эффективным противомалярийным препаратом. Во многих отношениях артемизинин является действительно захватывающим препаратом. Неудивительно, что от процесса его открытия, которое было тесно связано с традиционной китайской медициной (TCM), до его замечательной эффективности и воздействия в качестве противомалярийного препарата, артемизинин привлек к себе большое внимание с момента его бурного внедрения в мировую практику. Спустя 40 лет после своего открытия артемизинин остается нашей опорой против малярии и является основой всех основных методов лечения малярии. Годы исследований, охватывающих ряд дисциплин, ушли на изучение и выяснение механизмов действия артемизинина на малярийного плазмодия. Кроме того, были предприняты усилия по перепрофилированию артемизинина для применения в других сферах медицины , что значительно повысило ожидания относительно дальнейшей разработки этого препарата. Имея это в виду, мы считаем, что настало время широко пересмотреть историю этого важного препарата, охватывающую его прошлое, настоящее и будущее. Начиная с истории открытия и развития артемизинина, мы рассмотрим и обсудим современное понимание механизма действия (MOA) артемизинина при малярии. В заключение мы остановимся на текущих усилиях по перенаправлению артемизинина на возможные роли вне малярии. Мы полагаем, что эта статья обеспечит всестороннюю информацию об артемизинине, а также уместную информацию о важных темах, связанных с этим замечательным препаратом.
2. Путь исследования
Мы начнем с краткого описания замечательного путешествия, которое привело к открытию и развитию артемизинина. Записи малярии в TCM датируются тысячелетиями, и то же самое верно для использования растения Полынь (Qinghao) в качестве лекарственных трав. Впервые упомянутое как особое лекарство от малярийных симптомов в книге Чжоу Хоу Бейджи Фэна («Справочник рецептов на случай чрезвычайных ситуаций»), датируемой Восточной династией Цзинь (317–420 гг. Н. Э.). Применение Цинхао и других техник для облегчения малярии было впоследствии отмечено в серия исторических китайских медицинских сочинений, включающих в себя влиятельный текст «Bencao Gangmu (Бэнкао Гангму)» («Сборник материалов медицины») Ли Шичжэня (династия Мин, 1368–1644 гг. н.э.). Это богатство древних знаний позже оказалось полезным для открытия и развития артемизинина. В годы после Второй мировой войны разработка и внедрение мощного инсектицида дихлордифенилтрихлорэтана (ДДТ) и новых противомалярийных препаратов, таких как хлорохин (КК), привели к значительному прогрессу в борьбе с малярией. Однако кампания Всемирной организации здравоохранения (ВОЗ) в 1950-х годах по борьбе с малярией и ее ликвидации во всем мире в конечном итоге столкнулась с проблемами, связанными с сопротивлением. Появление резистентных к ДДТ переносчиков и лекарственно-устойчивых паразитов привело к возобновлению заболевания, особенно в таких регионах, как Юго - Восточная Азия и страны Африки к югу от Сахары. Эта неудача вызвала острую потребность в новых противомалярийных препаратах. Значительные усилия были предприняты Соединенными Штатами из-за войны во Вьетнаме и распространенности лекарственно устойчивой малярии в этом регионе. Примерно в это же время правительство Китая инициировало исследования малярии. В частности, был создан национальный проект под названием Проект 523 (названный в честь даты его открытия, 23 мая 1967 года) для консолидации исследований по малярии на национальном уровне. В 1969 году профессор Юю Ту был выбран руководить исследовательской группой в рамках проекта, который сосредоточился на скрининге TCM для новых противомалярийных препаратов. Эта работа проводилась в Институте китайской медицинской материи Китайской академии медицинских наук. На основе обширного хранилища знаний ТСМ, включающего древнюю литературу, фольклор и устные интервью с практикующими, Ту и его коллеги работали из списка из более чем 2000 травяных средств, из которых около 640 считались возможными ‘попаданиями‘». Из этого отбора в конечном итоге было собрано и протестировано более 380 экстрактов приблизительно из 200 трав (включая экстракты Цинхао / Артемизия), которые в основном дали неудовлетворительные результаты. Тем не менее, экстракт Цинхао вызвал особый интерес, начиная примерно с 1971 года, так как он дал многообещающие, но противоречивые результаты. Это открытие вызвало пересмотр литературы и привело к, возможно, наиболее важному прорыву в процессе открытий. Возвращаясь к самой ранней записи об использовании Цинхао для лечения малярийных симптомов, которая была в «Чжоу Чжоу Бэйцзи Фан» («Справочник рецептов на случай чрезвычайной ситуации») Хэ Хонга, Ту отметил, что инструкции по рецепту Цинхао касались употребления процеженного экстрагированного «сока» Цинхао. Примечательно, что в инструкции не упоминалось о нагревании лекарственного средства - то, что в остальном было обычным для предписаний в ТСМ. Опираясь на литературу и собственные знания TCM, Ту пришла в голову идея изменить процесс экстракции для использования в условиях низких температур. Экстракты, полученные по этой новой методике, были дополнительно очищены путем разделения кислой и нейтральной фаз с целью сохранения активных компонентов при одновременном снижении токсичности исходного экстракта.
Полученное вещество продемонстрировало поразительную 100% эффективность против малярии грызунов в экспериментах, проведенных примерно в октябре 1971 года. Этот замечательный результат был затем полностью воспроизведен в экспериментах на малярии обезьян, проведенных в конце декабря того же года, что позволило установить несомненную эффективность экстракта Цинхао [1].
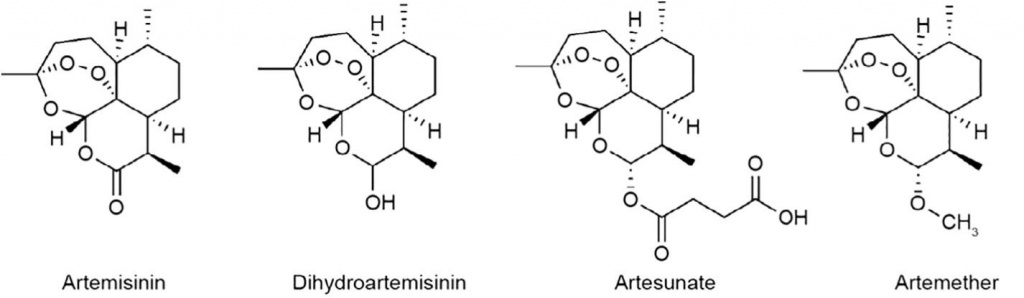

Прорыв был сделан, но путь разработки лекарства отнюдь не был завершен. В то время условия в Китае затрудняли проведение клинических испытаний новых кандидатов на лекарства для определения их безопасности для людей. В попытке ускорить процесс из-за сезонного и чувствительного ко времени характера исследования малярии, Ту и его коллеги решили добровольно выступить в качестве первых людей для испытаний на токсичность и определение дозы.Этот акт установил уровень безопасности экстракта Цинхао и позволил провести клинические испытания сразу же, во второй половине 1972 года. Испытания (которые проводились в провинции Хайнань и в больнице PLA 302 ) теперь включены в Пятый медицинский центр Китайской больницы общего профиля PLA в Пекине оказался успешным и проложил путь для продвижения исследований Цинхао на национальный уровень. Последующие согласованные усилия со стороны китайского научного сообщества в целом привели кдальнейшим исследованиям и разработкам Цинхао. Активный компонент самого экстракта Цинхао, артемизинин (также известный как Цинхаосу), был выделен в ноябре 1972 года группой Ту из Института китайской материальной медицины. Позже команда продолжит разработку дигидроартемизинина (ДГК), который на сегодняшний день остается одним из наиболее значимых фармакологических производных. В сотрудничестве с другими институтами по всему Китаю в следующем десятилетии была проведена дальнейшая работа по разработке лекарственных препаратов, включая определение стереоструктуры артемизинина и дальнейшую дериватизацию артемизинина. Эти усилия, в частности, завершились четвертым совещанием научной рабочей группы по химиотерапии малярии, состоявшимся в Пекине в 1981 году, на котором результаты впервые были представлены Ту. Результаты были опубликованы в 1982 году в виде серии работ под названием «Китайская совместная исследовательская группа по цингаосу и его производным в качестве противомалярийных средств»; таким образом, подарок от китайской медицины был доставлен остальному миру. После 1982 года артемизинин и его производные успешно применялись в Китае для лечения тысяч больных малярией. Поскольку проблема лекарственно-устойчивой малярии продолжала обостряться в других местах, это было незадолго до начала клинических исследований артемизинина в других эндемичных регионах Азии. Последовательные и обнадеживающие результаты привели к расширению таких исследований, особенно в отношении Африки. Было ясно, что терапия на основе артемизинина, особенно в сочетании с противомалярийным средством медленного действия, таким как мекохин или пиперахин, привела к значительным улучшениям в очистке от паразитов и быстрому уменьшению симптомов как неосложненной, так и тяжелой малярийной инфекции, вызываемой Plasmodium falciparum. В то же время было доказано, что его переносимость превосходна, поскольку сообщения о токсичности и безопасности остаются минимальными. Благодаря более чем десятилетним результатам независимых рандомизированных клинических исследований и метаанализов все более очевидной стала эффективность и безопасность терапии на основе артемизинина. Наконец, в 2006 году ВОЗ объявила об изменении своей стратегии, чтобы полностью использовать комбинированную терапию артемизинином (АКТ) в качестве первой линии лечения малярии. АCT остаются наиболее эффективными и рекомендуемыми противомалярийными препаратами на сегодняшний день.
3. Поиск механизма воздействия.
Прошло более десяти лет с момента внедрения ACT как официального средства для лечения малярии первой линии и более трех десятилетий с момента открытия артемизинина. За это время клинические и фармакологические характеристики терапии артемизинином были тщательно изучены и опубликованы. Хотя характеристики различных производных могут различаться, артемизининовые препараты характеризуются быстрым действием и эффективностью, низкой токсичностью и коротким периодом полувыведения, что делает комбинированную терапию противомалярийными препаратами пролонгированного действия идеальной и рекомендованной. Помимо его фармакологических свойств, выяснение MOA лекарственного средства является важным для оптимизации схем лечения. Дозировки, комбинации лекарств и даже соображения лекарственной устойчивости тесно связаны с молекулярной основой активности лекарства. Поэтому удивительно, что, несмотря на десятилетия широкого применения, наше понимание МОА артемизинина остается довольно неполным. Здесь мы даем краткий обзор преобладающего понимания, а также последних достижений в механистических исследованиях артемизинина. В целом, выдающиеся терапевтические свойства артемизинина можно рассматривать как результат двух основных процессов: его уникального механизма активации и его последующей активности и мишеней для лекарств. Эти механизмы в совокупности дают высокоэффективный, но в то же время высокоспецифичный препарат.
3.1. Активация лекарства
Артемизинин и его производные представляют собой сесквитерпеновые лактоны, которые несут 1,2,4-триоксановый фрагмент в качестве фармакофора. В частности, хорошо известно, что эндопероксидный мостик в этой группе необходим для фармакологической активности артемизинина. Артемизинины являются пролекарствами в двух смыслах: во-первых, многие производные быстро превращаются в DHA in vivo, и, во-вторых, их MOA зависит от активации путем расщепления эндопероксидного мостика. Механизм этого расщепления остается проблемой в активных исследованиях. Малярийные паразиты характеризуются обширным поглощением и перевариванием гемоглобина на эритроцитарной стадии их жизненного цикла. Это высвобождает обильное количество свободного окислительно - восстановительного гема и свободного двухвалентного железа (Fe2+), которые, как считается, лежат в основе противопаразитарного действия Артемизинина. Действительно, усвоение гемоглобина было тесно связано с восприимчивостью к артемизинину у паразитов. Было предложено несколько моделей в отношении механизма расщепления эндопероксида свободным окислительно-восстановительным гемом или свободным двухвалентным железом, а также последующих молекулярных событий, которые следуют за расщеплением. Эти предложения различаются с точки зрения природы расщепления и идентичности реакционноспособных интермедиатов, продуцируемых активацией лекарственного средства. В общих чертах, однако, они объясняют специфическую для паразитов активацию лекарственного средства, посредством которой образуются реактивные виды, что приводит к повреждению клеток и уничтожению паразита. Последние данные свидетельствуют о том, что свободный редокс - активный гем может играть доминирующую роль в активации лекарств. Исследование 2008 года предоставило данные in vitro, которые показали, что железистый гем может быть более сильным активатором артемизинина, чем другие железосодержащие вещества, включая гемин, свободное железное железо и непереваренный гемоглобин. Аналогичные наблюдения были сделаны на живых паразитах, у которых активация артемизинина блокировалась путем ингибирования переваривания гемоглобина, но не путем хелатирования свободного двухвалентного железа. Таким образом, процесс усваивания гемоглобина в инфицированных эритроцитах, необходимый для роста паразитов, является ключом к специфичности активации артемизинина. Интересно, что в исследованиях с использованием дрожжевых клеток в качестве посредника для малярийных паразитов было обнаружено, что митохондрии непосредственно участвуют как в активации, так и при действии артемизинина, таким образом, дополнительно связывая действие артемизинина с реактивными окислительными видами (АФК) производственный и окислительный ущерб. Также возможно, что множественные избыточные пути активации могут существовать в разных средах или местах, где условия и величина активации могут отличаться. Заглядывая в будущее, будет крайне важно рассмотреть основную роль активации лекарств в активности артемизинина и дополнительно выяснить его механизмы в различных условиях.
3.2. Нижерасположенный механизм
Важным шагом в выяснении МОА лекарственного средства является выявление его клеточных целей. В общепринятом понимании конструкции и механизмов лекарственного средства лекарственное средство модифицирует одну или несколько конкретных клеточных мишеней, таких как белки, для осуществления последующих изменений. Однако, чрезвычайно быстродействующий и мощный характер активности артемизинина в сочетании с его способностью алкилировать мишени может быть обусловлен совершенно другим механизмом. Прежде всего, гем освобождается от функций пищеварения гемоглобина, которые выходят за рамки активации лекарственного средства, как было указано ранее. Избыточный гем превращается в инфицированных эритроцитах в гематин, который токсичен для паразита через окислительное повреждение и прямой лизис клеточных мембран. Таким образом, малярийные паразиты выработали механизм детоксикации, который превращает гематин в нетоксичный и инертный кристаллизованный гемозоин посредством процесса биокристаллизации. Сообщалось, что активированный артемизинин предотвращает образование гемозоина путем алкилирования гема; поэтому он действует аналогично другим противомалярийным препаратам, влияющим на образование гемозоина, таким как CQ. Таким образом, свободный гем от переваривания гемоглобина служит как активатором, так и мишенью для артемизинина. Учитывая, что активированный артемизинин, как считается, генерирует АФК, неудивительно, что сообщалось также, что артемизинин напрямую алкилирует белковые мишени. Трансляционно-контролирующий опухолевый белок (TCTP) и Ca2+ - это АТФаза PfATP6 Plasmodium sarco / эндоплазматический ретикулум; были среди первых интересующих мишеней, которые были определены как взаимодействующие партнеры артемизинина. Рассмотрение роли отдельных мишеней в активности артемизинина теперь переросло в МОА, которые могут зависеть от нескольких мишеней, как показали более поздние исследования. Используя несмещенные методы протеомики, было замечено, что нацеливание на артемизинин может быть беспорядочным, а не монотаргетическим. В первом исследовании, в котором систематически сообщалось о мишенях, связывающих артемизинин, было выявлено более 100 белков в живых штаммах паразитов. Независимое исследование, проведенное Ismail в итоге привели к следующим результатам. Эти результаты подтверждают беспорядочный механизм нацеливания на артемизинин, при котором активированный артемизинин алкилирует и повреждает многие клеточные белки, нарушая тем самым множество ключевых биологических функций и приводя к токсичности и летальности для паразитов. Интересно, что PfATP6 и другие ключевые транспортеры, такие как PfCRT и Pfmdr1, последовательно помечаются в этих типах экспериментов. Эти данные согласуются с тем, что PfATP6 является важной мишенью для артемизининов. В качестве независимой линии доказательств, картированные сайты связывания артемизинина с TCTP также поддерживают активируемый гемами беспорядочный механизм, в котором сайты модификации основаны на близости и по существу случайны. Наши современные знания об артемизинине рисуют картину препарата с уникальным и элегантным механизмом. Артемизинин и его производные являются пролекарствами, которые абсолютно требуют расщепления эндопероксидной группы для активации лекарственного средства и последующей антипаразитарной активности. Активация артемизинина зависит от богатой гемом среды, которая специфична для инфицированных эритроцитов, а также является неизбежным результатом метаболизма паразитов. Само богатое гемом окружение затем используется активированным лекарственным средством для эффективного уничтожения паразитов. Этот механизм по существу связывает заражение и рост паразитов с активацией лекарственного средства, обеспечивая таким образом как выдающуюся специфичность, так и переносимость терапии артемизинином. В то же время активированный артемизинин беспорядочно повреждает проксимальные белки и клеточные структуры. Вместо того, чтобы воздействовать на отдельный белок или клеточную функцию, как и большинство обычных лекарств (включая большинство противомалярийные препаратов), артемизинин действует как менее дискриминационная «бомба», которая детонирует при активации, вызывая повсеместный ущерб. Поэтому можно предположить, что специфичность артемизинина основана на его активации, а не на его мишенях. Эти уникальные свойства артемизинина делают его почти идеальным оружием против малярии, особенно в сочетании с другими лекарственными средствами, которые действуют через различные механизмы и дополняют фармакологический профиль артемизинина. Здесь также следует отметить очевидное преимущество беспорядочно нацеленного лекарственного средства: развитие лекарственной устойчивости гораздо сложнее, когда мутации в одной или нескольких конкретных мишенях недостаточно для серьезного воздействия лекарственной активности. Это преимущество вполне может объяснить, почему артемизинин остается в целом эффективным, несмотря на его повсеместное использование в течение десятилетий. Тем не менее, недавние тенденции сигнализируют о распространенности и распространении малярии, которая медленнее очищается от АКТ, особенно в эндемичных регионах Азии. Эта тема была всесторонне освещена с разных сторон недавними обзорами и комментариями. Независимо от разногласий по поводу точного определения устойчивости к «артемизинину» в данной области, угроза, несомненно, реальна, учитывая место, которое артемизинин занимает в борьбе с малярией. Чтобы решить эту острую проблему, необходимо преодолеть две основные проблемы:
1. Необходимо достичь полного понимания МОА артемизинина;
2. Генетические и физические особенности вновь появившихся штаммов, устойчивых к артемизинину, должны быть определены. Несмотря на то, что МОА тщательно исследуется последние несколько лет, молекулярная характеристика устойчивой к артемизинину малярии далеко не ясна. Необходимы постоянные усилия для достижения полной картины того, как устойчивость к артемизинину связана с его способом действия. Основываясь на этих новых знаниях, можно разрабатывать и тестировать новые терапевтические стратегии.
Перепрофилирование артемизинина
Терапия артемизинином характеризуется его выдающейся переносимостью и относительной доступностью. Эта комбинация доказанной безопасности и доступности делает артемизинин препаратом исключительного интереса для повторных исследований. Действительно, интерес к немалярийным применениям артемизинина со временем неуклонно возрастал с тех пор, как артемизинин впервые стал известен миру. В то время как малярия остается единственным заболеванием, для которого артемизинин является одобренным лечением, потенциальные применения артемизинина в противораковых, противовоспалительных, противопаразитарных (за пределами малярии) и противовирусных ролях, среди прочего, были изучены всерьез на протяжении многих лет. Здесь мы вкратце
прокомментируем некоторые многообещающие исследования в области применения артемизинина, особенно в области лечения рака, в качестве окна для будущей разработки лекарств. Эффективность артемизинина в онкологии впервые была описана в 1993 году, и с тех пор она была расширена и широко охарактеризована. В настоящее время хорошо известно, что артемизинин и его производные проявляют селективную цитотоксичность в отношении ряда типов рака как в исследованиях in vitro, так и in vivo. Наблюдения за клиническими испытаниями были, как правило, многообещающими, если их количество и масштаб ограничены. Более двух десятилетий исследований, основанных на действии артемизинина при раке, выявили множество предполагаемых целей и механизмов. Сообщалось, что артемизинин вызывает митохондриальный апоптоз и другие формы гибели клеток, такие как некроптоз, ингибирует ангиогенез и метастазирование рака и останавливает раковый клеточный цикл. Сообщается, что эти результаты опосредованы сочетанием окислительного повреждения, повреждения ДНК, изменения экспрессии генов и взаимодействия с широким спектром сигнальных путей, включая мишень рапамицина (mTOR), NF-jB, митоген-активируемый протеин (MAP) киназы млекопитающих. и Wnt / b-catenin, среди многих других. Эти пути и механизмы были подробно рассмотрены в недавних публикациях. Несмотря на то, что валидация путей является важным аспектом механического исследования, необходимо также рассмотреть общую картину с точки зрения объединения активации лекарств и последующей деятельности таким же образом, как это было сделано в исследованиях малярии. Как и в случае с малярийными паразитами, механизм активации артемизинина в раковых клетках, вероятно, тесно связана с его специфическим действием. Таким образом, роль свободного двухвалентного железа в сравнении со свободным окислительно-восстановительным гемом вновь подвергается тщательному анализу, особенно с учетом того, что железо тесно связано с индуцированной артемизинином цитотоксичностью при раке. Недавние исследования еще раз пролили свет на роль гема в активации артемизинина в раковых клетках, тем самым проводя параллели со случаем малярии. В частности, ряд методик был использован для демонстрации того, что модуляция синтеза и доступности гема четко коррелирует с цитотоксичностью. Также важно отметить, что раковые клетки, как сообщается, обладают повышенными уровнями метаболизма и синтеза гема, и что это может подкреплять специфичность рака артемизинина аналогично случаю малярии. Специфическое нацеливание артемизинина на митохондрии (сайт синтеза гема в клетках млекопитающих) или повышение уровня гема путем лечения предшественником гемолина аминолевулиновой кислотой (АЛК) улучшало противораковую активность. Гемоцентрический механизм активации и железозависимый механизм нисходящей цитотоксичности может быть точкой примирения между ролями этих двух видов в противораковой активности артемизинина. Дальнейшая работа по полному пониманию основ артемизинина при раке будет иметь решающее значение для будущих терапевтических применений. В то же время, необходимо учитывать соответствующее направление при продвижении вперед с точки зрения валидации артемизинина MOA при раке. Рассмотрим случай малярии, где артемизинин предлагается атаковать смежные цели без разбора при активации. Если артемизинин активируется подобным образом в раковых клетках, вполне вероятно, что будет иметь место тот же беспорядочный многоцелевой механизм. Это объяснило бы замечательный диапазон клеточных эффектов и предполагаемых путей, о которых уже сообщалось, поскольку такой механизм может одновременно воздействовать на множество целей и функциональных путей. Действительно, недавние непредвзятые исследования мишеней рака артемизинина с использованием протеомных подходов выявили сходную многоцелевую МОА артемизинином в раковых клетках. Механизм самой цитотоксичности также вызывает большой интерес, особенно в отношении неапоптотических форм гибели клеток. Недавние работы тесно связывают индуцированную артемизинином цитотоксичность с окислительным повреждением и лизосомальной функцией, уделяя особое внимание роли железа в содействии железо-зависимой форме гибели клеток, известной как ферроптоз. В частности, опосредованная лизосомами деградация ферритина в условиях аутофагии (так называемая ферритинофагия) высвобождает свободное металлическое железо, что, в свою очередь, способствует как ферроптозу, так и железо-опосредованной генерации АФК . Аутофагия сама по себе является клеточным процессом, который, как сообщается, активируется артемизинином, но оказывает неоднозначное влияние на выживаемость раковых клеток и цитотоксичность артемизинина. Ясно, что взаимосвязь между аутофагией, лизосомальной активностью, свободным двухвалентным железом и гибелью железозависимых ферроптотических клеток после воздействия артемизинина представляет большую область неопределенности в противораковом механизме артемизинина. Тем не менее, усилия по раскрытию новых, специфичных для рака мишеней и механизмов постоянно продолжаются и продолжают вносить вклад в общее представление об артемизинине как противораковом лекарстве. Опосредованное артемизинином воздействие на раковые стволовые клетки, иммуномодуляцию, метастазирование рака, метаболизм рака, включая регуляцию гликолиза, и множество сигнальных путей, включая преобразователь сигнала и активатор транскрипции 3 (STAT3), NF-jB, mTOR, и передача сигналов CREBP относится к числу последних сообщений и указывает новые направления для дальнейшей проверки. В частности, заслуживает внимания потенциальная способность артемизинина служить иммуномодулятором при раке за счет регуляции регуляторной активности Т-клеток (Treg) и продукции иммуносупрессивных цитокинов, способствующих выживанию при раке, таких как простагландин E2 (PGE2), учитывая комплекс. Роль иммуномодулирующих препаратов в терапии рака. Наконец, усилия по совершенствованию рецептуры и доставки препаратов на основе артемизинина показали перспективность в повышении эффективности и снижении восприимчивости к лекарственной устойчивости. Эти результаты включают новые синтетические димеры, тримеры и лекарственные конъюгаты (особенно системы, связанные с трансферрином), в дополнение к комбинированной терапии; они представляют интересную постоянную область исследований, которые были всесторонне рассмотрены в недавних публикациях. В дополнение к возможному применению артемизинина в лечении рака, ведутся активные исследования его потенциальной роли в лечении ряда других заболеваний. В частности, противовоспалительные эффекты против аутоиммунных заболеваний и аллергической астмы, среди других состояний, были зарегистрированы в ряде моделей заболеваний. Некоторые из этих результатов коррелируют с наблюдениями иммуносупрессии у пациентов, получающих лечение артемизинином от малярии. Сильные противовирусные эффекты артемизинина были также зарегистрированы у герпеса и вирусов гепатита B и C, и было показано, что другие паразитарные заболевания, включая шистосомоз, также реагируют на лечение артемизинином. Недавние исследования даже выявили замечательную, хотя и противоречивую, роль артемизинина в диабете за счет индуцирования трансдифференцировки клеток поджелудочной железы с образованием В-клеток. МОА для этих альтернативных применений часто обсуждается с точки зрения канонической модели генерации АФК и индукции окислительного повреждения при расщеплении эндопероксидом; однако также были предложены неканонические (в том числе независимые от эндопероксида) механизмы, особенно в случае иммуномодуляции. Будет важно получить четкое представление о том, как механизмы и функции лекарственного средства могут различаться при различных применениях и условиях, учитывая при этом важность условий активации лекарственного средства. Стоит также отметить, что лучше всего проводить повторные исследования на пациентах и в регионах, которые не обременены малярией или не подвержены ее риску, чтобы избежать возможных помех или осложнений. Необходимо приложить все усилия, чтобы весь потенциал артемизинина мог быть реализован без ущерба для его текущих применений.
Артемизинины - это класс замечательных лекарств, которые изменилиландшафт противомалярийной терапии. Сочетание выдающегося потенциала, безопасности и доступности поставило артемизинин в авангарде продолжающейся борьбы с малярией, где он уже повлиял на миллионы жизней. С момента своего открытия совместными усилиями мирового сообщества была собрана картина действия лекарства с уникальным набором свойств, которые делают его почти идеальным противомалярийным препаратом. Активные исследования в других областях также выявили широкий спектр многообещающих применений для артемизинина за пределами малярии. Мы полагаем, что логично стремиться максимизировать полезность этого препарата в различных областях. В контексте малярии это означает дальнейшее выяснение механизмов активации и действия артемизинина при одновременном улучшении его фармакологических свойств как в отдельности, так и в сочетании. В сочетании с четким пониманием принципов активности артемизинина это может стать ключом к устранению неопределенности в отношении устойчивости к артемизинину. Такие усилия гарантируют, что лекарство может продолжать работать в аналогичном или даже более высоком качестве в той роли, которую оно выполняло так долго. Забегая вперед, повторное использование исследований, основанных на четком понимании различий МОА при различных заболеваниях и системах, также будет способствовать определению будущего артемизинина. В конечном счете, мы искренне надеемся, что этот дар китайской медицины может продолжать служить достижению здоровья для людей во всем мире на многие годы вперед.