Лекарственные грибы с противовирусным действием
Аннотация:
Пандемии, вызванные различными вирусами, снова и снова подвергают опасности живые организмы. Поэтому для решения этой проблемы необходимо как можно скорее создать новые противовирусные препараты. Однако фармацевтические исследования и разработки являются нелегкой задачей, в то время как общество нуждается в новых противовирусных компонентах.
Ряд лекарственных грибов, таких как трутовик лакированный (Ganoderma lucidum) и кордицепс китайский (Cordyceps sinensis) широко применяется во всем мире. Они способны повысить иммунитет человека и оказать непосредственное противовирусное действие. Лекарственные грибы применяются в пищу или как пищевые добавки. В этом обзоре различные виды лекарственных грибов, обладающих противовирусной активность и содержащих противовирусные компоненты, были рассмотрены с точки зрения влияния на вирусы человека, животных и растений в попытке представить исчерпывающую теорию, основанную на оптимальном клиническом использовании лекарственных грибов в качестве противовирусных агентов.
1. Введение
В современном мире вспышка многих инфекционных болезней представляет собой серьезную угрозу для жизни и здоровья человека. Тысячу лет назад эпидемия оспы унесла десятки тысяч человеческих жизней [1]. Сейчас эпидемия вируса SARS-CoV-2 толкнула человечество к краю обрыва. Вспышки большинства этих инфекционных заболеваний связаны с вирусными инфекциями. На данный момент наибольшую угрозу для человека представляют РНК-содержащие вирусы, так как они быстро мутируют в процессе репликации и обратной транскрипции [2]. Это значительно усложняет предотвращение и лечение РНК-содержащих вирусов. Классические противовирусные препараты, такие как интерферон и рибавирин, эффективны против большинства вирусов in vitro, но не всегда для пациентов. Это связано с рядом проблем, среди которых устойчивость к лекарственным средствам и высокая стоимость существующих препаратов [3,4]. Необходимо как можно скорее найти более подходящие противовирусные средства.
Лекарственные грибы широко применяются по всему миру. В Пакистане около 23 видов лекарственных грибов используются для лечения простуды, кашля, гриппа, астмы и других заболеваний [5]. В Соединенных Штатах Америки трутовик лакированный (Ganoderma lucidum) добавлен в Американскую травяную фармакопею и Программу лечения [6]. Медицинское использование лекарственных грибов в Китае имеет долгую историю; в книге, посвященной траволечению, «Шэньнун Бен Цао Цзин», есть записи, которые были сделаны приблизительно 2 000 лет назад [7]. Грибы могут быть использованы для профилактики и лечения заболеваний, они также обладают значительной биологической активностью и медицинской ценностью. В мицелии, плодовом теле или спорах может образовываться ряд веществ, таких как белки, полисахариды и алкалоиды, которые оказывают благоприятное влияние на здоровье человека [8]. Их противовирусное, противораковое и противовоспалительное действия в последнее время привлекают все больше и больше внимания [9–11]. Благодаря своим необычным свойствам токсичность лекарственных грибов намного ниже по сравнению с синтетическими препаратами. В течение последних несколько лет некоторые грибы постепенно перешли в разряд лекарственных и съедобных. Лекарственные грибы завоевывают все большее доверие следи людей.
Противовирусные полисахариды в составе лекарственных грибов были хорошо изучены [7]. В этой статье мы собрали информацию касающуюся макромолекулярных и низкомолекулярных противовирусных компонентов лекарственных грибов, и классифицировали их по вирусам человека, животных и растений (Таблицы 1 и 2).
Цель данного обзора - предоставить материал для использования лекарственных грибов в области защиты от вирусов и способствовать дальнейшим противовирусным исследованиям.
Таблица 1. Противовирусная активность лекарственных грибов и их механизм действия на вирусы человека
|
Вирус |
Химический класс |
Противовирусный агент |
Источник |
Механизм действия |
Ссылка |
|
SARS- CoV-2 |
Полисахарид |
Полисахариды, содержащие L-фукозу |
Ganoderma lucidum |
Vitro |
[12] |
|
Тритерпены, белок |
Ganoderma lucidum, Grifola frondosa и др. |
Ингибирование активности АПФ |
[13] |
||
|
Стероид |
Антцины |
Antrodia cinnamomea |
Ингибироание АПФ-2 |
[14] |
|
|
Полисахарид |
20% α-глюканы |
Lentinus edodes |
Регуляция иммунной системы |
[15] |
|
|
Полисахарид |
Карбосинт-лентинан (50%β-глюкан 12%α-глюкан) |
Lentinus edodes |
Уменьшает воспаление в легких |
[16] |
|
|
Полисахарид |
Собственный лентинан (72%β-глюкан) |
Lentinus edodes |
Уменьшает воспаление в легких |
[16] |
|
|
Аденозин |
Кордицепин(C10H13N5O3) |
Cordyceps sinensis |
Ингибитор шиповидного белка |
[17] |
|
|
IV |
Сырой экстракт |
ME, MFs (MF1, MF2 и MF3) |
Grifola frondosa |
Vitro индуцирует производство цитокинов, таких как ФНО-α, которые замедляют распространение вируса in vitro |
[18] |
|
Пиранон |
Феллигридины E, G |
Phellinus igniarius |
Vitro ингибирующее действие по отношениюк нейраминидазе |
[19] |
|
|
Сырой экстракт |
Водный экстракт PIW |
Phellinus igniarius |
Vitro влияет на ранний процесс репликации вируса |
[20] |
|
|
Сырой экстракт |
Экстракт мицелия Lentinus edodes LEM |
Lentinus edodes
|
Vitro ингибирует попадание вируса в клетки хозяина активирует иммунный ответ через пути ИФН I типа |
[21] |
|
|
Терпеноиды |
Криптопористая килсота E |
Cryptoporus volvatus |
Vitro |
[22] |
|
|
Сырой эксракт |
Водный экстракт |
Cryptoporus volvatus |
Vitro |
[23] |
|
|
Полисахарид |
APS (D-галактоза, L-арабиноза, D-ксилоза, L-рамноза и галактуроновая кислота) |
Cordyceps militaris |
Vitro |
[24] |
|
|
Сырой экстракт |
Cordyceps militaris |
Vivo повышенная экспрессия ИЛ-12 и болшее число NK-клеток |
[25] |
Таблица 1. Продолжение
|
Вирус |
Химический класс |
Противовирусный агент |
Источник |
Механизм действия |
Ссылка |
|
|
Сырой экстракт
|
|
Auuriporia aurea, Flammulina velutipes, Fomes fomentarius, Ganoderma lucidum, Lentinus edodes, Lyophyllum shimeji, Pleurotus eryngii, Pleurotus ostreatus, Schizophyllum commune и Trametes versicolor |
Vitro |
[26] |
|
Жирная кислота |
(2Z,4E)-дека-2,4- диеновая кислота (DDEA) |
Cordyceps sinensis |
Уменьшает воспаления, вызванного инфекцией H1N1 |
[27] |
|
|
Полисахарид |
PCP-II (фукоза, манноза, глюкоза и галактоза в молярном соотношении 1.00:1.63:0.16:6.29) |
Poria cocos |
Адъювант вакцины |
[28] |
|
|
Полисахарид |
Смешанные полисахариды (MP) |
шиитаке, poriacocos, имбирь, цедра мандарина |
Повышение уровня клеточного и гуморального иммунитета |
[29]
|
|
|
EV71
|
Полисахарид |
Нейтральные полисахариды, имеющие β-1,6-связанный Glcp основание с единицами 1,3-α-глюкана |
Grifola frondosa |
Vitro ингибирование экспресии белка VP1 и синтеза геномной РНК |
[30] |
|
Полисахарид |
95% полисахариды (глюкоза 79% и манноза 21%) и 5% белка |
Ganoderma lucidum |
Адъювант вакцины |
[31] |
|
|
Тритерпеноид |
Ланоста-7,9(11),24-триен-3-он,15;26- дигидрокси (GLTA) и ганодериновая кислота Y (GLTB) |
Ganoderma lucidum |
Vitro замедляет репликацию вирусной РНК путем блокирования EV71 |
[32] |
|
|
ВИЧ |
Аденозин |
Кордицепин(C10H13N5O3) |
Cordyceps sinensis |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 8,2×10–3 мкM |
[33] |
|
Водный экстракт |
|
Cordyceps sinensis |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 |
[34] |
|
|
Аденозин |
L3a(C10H13N5O4), L3b(C20H20O7), L3c(C12H17N5O5) |
Cordyceps militaris |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 |
[35] |
|
|
Лектин |
Последовательность N-концевой аминокислоты (NSTDISLNHG) Молекулярная масса 30 Да |
Cordyceps militaris |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 10 мкM |
[36] |
|
|
Лектин |
Последовательность N-концевой аминокислоты (QYSQMAQVME) Молекулярная масса 32,4 кДа |
Pleurotus ostreatus |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 0,93 мкM |
[37] |
Таблица 1. Продолжение
|
Вирус |
Химичекий класс |
Противовирусный агент |
Источник |
Механизм действия |
Ссылка |
|
Белок |
Последовательность N-концевой аминокислоты (AEGTLLGSRA TCESGNSMY) Молекулярная масса 9567 Да |
Hypsizigus marmoreus |
Vitro ингибирующая активность на обратную транскриптазу ВИЧ-1 IC50 30 нМ |
[38] |
|
|
Белок |
Последовательность N-концевой аминокислоты (XHPDLFXX) молекулярная масса 13,8 кДа |
Flammulina velutipes |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 |
[39] |
|
|
Гемолизин |
Последовательность N-концевой аминокислоты (ATNYNKCPGA) Молекулярная масса 29 кДа |
Schizophyllum commune |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 1,8 мМ |
[40] |
|
|
Рибонуклеаза |
Последовательность N-концевой аминокислоты (TPYLDYLAAL QADGPVVPFIRNWE- GALSIS) Молекулярная масса 20 кДа |
Schizophyllum commune |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 65 нМ |
[41] |
|
|
Сырой экстракт |
NGC и AGC |
Ganoderma lucidum |
Vitro ингибирующее действие по отношению к припреклению гликопротеина ВИЧ-1 120 к кластеру дифференциации 4 |
[42] |
|
|
Тритерпеноид |
Ганодериновая кислота B |
Ganoderma lucidum |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 |
[43] |
|
|
Тритерпеноид |
Ганодериновая кислота β, люцидумол B, ганодерманондиол, ганодерманонтриол, ганолюцидная кислота A |
Ganoderma lucidum |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 20, 50, 90, 70, 70 мкМ |
[44] |
|
|
Тритерпеноид |
Ганодериол F и ганодерманонтриол |
Ganoderma lucidum |
Vitro анти-ВИЧ-1 активность с подавлением концентрация 7.8 мкг/мл |
[45] |
|
|
Тритерпеноид |
Ганодериновая кислота B, ганотериол B, ганодериновая кислота C1, 3B-5a-дигидрокси-6b-метоксиэргоста-7,22-диен, ганодериновая кислота a, ганодериновая кислота H и ганодериол A |
Ganoderma lucidum |
Vitro ингибиторная активность в отношении обратной транскриптазы ВИЧ-1 IC50 0,17-0,23 мМ |
[45] |
|
|
Полисахарид |
PSP (28% соотношение полисахарид-пептид и состав 60,23 мг/г бета-1,3/1,6-глюкан) |
Coriolus versicolor |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 6.25 мкг/мл ингибирование взаимодействия между ВИЧ-l gp120 и иммобилизованным рецептором CD4 |
[46,47] |
Таблица 1. Продолжение
|
Вирус |
Химический класс |
Противовируснвй агент |
Источник |
Механизм действия |
Ссылка |
|
Лакказа |
Последовательность N-концевой аминокислоты (AGTSHFADL) молекулярная масса 67 кДа |
Lentinus edodes |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 7,5 мкМ |
[48] |
|
|
Белок |
Последовательность N-концевой аминокислоты (CQRAFN- NPRDDAIRW) молекулярная масса 27,5 кДа |
Lentinus edodes |
Vitro ингибирующая активность в отношении обратной транскриптазы ВИЧ-1 IC50 1,5 мкМ |
[49] |
|
|
Лигнин |
Элементный анализ; C, 44.6%; H, 4.68%; N, 1.74% |
Lentinus edodes |
Vitro |
[50] |
|
|
Водный экстракт |
E-P-LEM и LEM |
Lentinus edodes |
Vitro |
[51] |
|
|
ВПЧ |
Сырой экстракт |
Порошки плодового тела |
Trametes versicolor, Ganoderma lucidum |
Vivo |
[52] |
|
Сырой экстракт |
Негормональный гель |
Trametes versicolor |
Vivo |
[53] |
|
|
DENV |
Конидии |
Конидии |
Beauveria bassiana |
Vivo активация путей Toll и JAK-STAT комаров против лихорадки денге |
[54] |
|
Аденозин |
Кордицепин(C10H13N5O3) |
Cordyceps sinensis |
Vitro ингибирование репликации вирусной РНК |
[55] |
|
|
Сырой экстракт |
Горячие водные экстракты и водные растворимые экстракты |
rhinocerotis, Pleurotus giganteus, Hericium erinaceus, Schizophyllum commune |
Vitro |
[56,57] |
|
|
Водный экстракт |
Гесперидин |
Ganoderma lucidum |
Vitro активность протеазы NS2B-NS3 против DENV |
[58] |
|
|
Тритерпен |
Ганодерманонтриол |
Ganoderma lucidum |
Vitro |
[59] |
|
|
HV HBV |
Сырой экстракт |
Сырой экстракт |
Cordyceps sinensis |
Уменьшение апоптоза клеток почечного эпителия |
[60] |
|
Сырой экстракт |
Экстракт GF-D |
Vitro непосредственное влияние на репликацию HBV на уровне ДНК-полимеразы |
[61] |
||
|
Полисахарид |
β-глюкан с основанием (1-3)-β-глюкозой и боковыми цепями (1-6)-β-глюкозы |
Polyporus umbellatus |
Лечение гепатита, вызванного HBV |
[62] |
|
|
Полисахарид |
Глюкан |
Schizophyllum commune |
Модуляция клеточных и гуморалных иммунных ответов |
[63] |
|
|
Сырой экстракт |
Коферментированный бульон |
Ganoderma lucidum и Radix Sophorae flavescentis |
Vitro |
[64] |
|
|
Тритерпен |
Ганодериновая кислота |
Ganoderma lucidum |
Vitro |
[65] |
Таблица 1. Продолжение
|
Вирус |
Химический класс |
Противовирусный агент |
Источник |
Механизм действия |
Ссылка |
|
HCV |
Полисахарид |
LEP-1 (глюкоза72,15%, галактоза 12,12%, манноза 10,02%) LEP-2(глюкоза 79,40%, галактоза 7,12%, мвнноза 6,92%) |
Lentinus edodes |
Vitro |
[66] |
|
Сырой экстракт |
MSCE и LM-лигнин |
Lentinula edodes |
Ингибирование попадания HCVpv в клетки |
[67] |
|
|
Аденозин |
Кордицепин(C10H13N5O3) |
Cordyceps militaris |
Ингибирование репликации РНК HCV in vitro ингибирование активности полимеразы NS5B |
[68] |
|
|
HV ВПГ |
Белок |
Последовательность N-концевой аминокислоты (NH2-REQDNAPCGLN- COOH) молекулярная масса 29,5 кДа |
Grifola frondosa |
Vitro и vivo |
[69] |
|
Сырой экстракт |
JLS-SO01 |
Lentinus edodes |
Vitro блокирование репликации HSV-I на более поздней стадии цикла репликации вируса |
[70] |
|
|
Полисахарид |
APBP полисахарид (приблизительно 40.6%) и белок (приблизительно 7,80%) полярное соотношение углеводов (C:H:O = 1:2:1) |
Ganoderma lucidum |
Vitro |
[71–73] |
|
|
Сырой экстракт |
Водорастворимые экстракты GLhw и GLlw и восемь видов метанолорастворимых экстрактов GLMe-1-8 |
Ganoderma lucidum |
Vitro |
[74] |
|
|
Сырой экстракт |
Травяная смесь WTTCG |
Ganoderma lucidum |
Vivo |
[75] |
|
|
ВЭБ |
Аденозин |
Кордицепин(C10H13N5O3) |
Cordyceps sinensis |
Vitro Влияние на синтез вирусного белка путем воздействия на гены ВЭБ |
[76] |
|
Терпеноид |
люциденовая кислота P, метиллюциденаты Р, метиллюциденаты Q |
Ganoderma lucidum |
Ингибирующее влияние на раннюю индукцию антигена вируса Эпштейна-Барр |
[77] |
|
|
Терпеноид |
Ганодериновая кислота A, ганодериновая кислота B, ганодерол B, ганодерманонтриол, ганондерманондиол |
Ganoderma lucidum |
Vitro |
[78] |
|
|
РСВ |
Белок |
осадок 114 аминокисот молекулярная масса 13 к Да |
Flammulina velutipes |
In vivo уменьшение вирусных титров РСВ, снижающих транслокацию NF-jB |
[79] |
Таблица 1. Продолжение
|
Вирус |
Химический класс |
Противовирусный агент |
Источник |
Механизм действия |
Ссылка |
|
ПВ |
Сырой экстракт полисахарид |
LeP(β-D-глюкан) водные (AqE) и этаноловые (EtOHE) экстракты |
Lentinus edodes |
Vitro |
[80] |
|
ВБ |
Полисахарид |
Фукоза, манноза, глюкоза и галактоза в молярном соотношении 1,00:1,63:0,16:6,29. |
Poria cocos |
Адъювант для вакцины от бешенства |
[81] |
|
MARV |
Полисахарид |
PCP-II (фукоза, манноза, глюкоза и галактоза в молярном соотношении 1,00:1,63:0,16:6,29) |
Poria cocos |
Адъювант вакцины |
[82,83] |
Таблица 2. Противовирусная активность лекарственных грибов и их механизм действия на вирусы растений и животных.
|
Вирус |
Химический класс |
Противовирусный агент |
Источник |
Механизм действия |
Ссылка |
|
|
Вирусы животных |
IHNV |
Полисахарид |
LNT-I β-(1→3)-глюкан в основании с боковыми цепями -(1→6)-глюкозила, манноза и галактоза в молярном соотношении 19,26:1,20:1,00 |
Lentinus edodes |
Vitro непосредственная деактивация вируса и ингибирование репликации вируса |
[84] |
|
MDRV |
Полисахарид |
HEP глюкоза (51,02%), галактоза (42,24%), манноза (4,5%) и арабиноза (2,2%) |
Hericium Erinaceus |
Vivo нормализация количества клеток слизистой кишечника, связанных с иммунитетом регуляция процесса самонаведения лимфоцитов мускусной утки |
[85,87] |
|
|
WSSV |
Полисахарид |
β-1,3 глюкан BG |
Schizophyllum commune |
Укрепляет иммунитет креветки |
[88] |
|
|
ВИК |
Сырой экстракт |
Этаноловый экстракт |
Inonotus obliquus |
Vitro Ингибирование обратной транскриптазы ВИК |
[89] |
|
|
Сырой экстракт |
Коммерчески доступное соединение HELP-TH1 |
Ganoderma lucidum, Cordyceps sinensis, Trametes versicolor |
Vitro |
[90] |
||
|
DWV LSV |
Сырой экстракт |
Fomes fomentarius, Ganoderma applanatum |
Vivo |
[91] |
||
|
NNV |
Белок |
Рекомбинированный белок rLZ-8 |
Ganoderma lucidum |
Vivo активация иммунной защиты |
[92] |
|
|
ЦВС-2 |
Полисахарид |
PS (D-глюкоза, D-ксилоза, D-галактоза, L-фукоза, D-манноза и L-рамноза в молярном соотношении 5,35:2,67:1:1,19:0,38:0,37) |
Ganoderma lucidum |
Адъювант вакцины |
[93] |
|
[93]
Таблица 2. Продолжение
|
Вирус |
Химический класс |
Противовирусный агент |
Источник |
Механизм действия |
Ссылка |
|
|
CM-H-L-5 |
Cryptoporus volvatus |
Vitro |
[94] |
|||
|
ВРРСС |
Эргостерол |
5α,8α-эпидиокси-22E-эргоста6,22-диен-3β-ол |
Cryptoporus volvatus |
Vitro |
[95] |
|
|
Сырой экстракт |
Водный экстракт |
Cryptoporus volvatus |
Vitro и vivo ингибирование попадания ВРРСС и синтез РНК ВРРСС |
[96] |
||
|
PDCoV |
Тритерпен |
Пероксид эргостерола EP |
Cryptoporus volvatus |
Vitro и vivo активация сигнальных путей p38/MAPK и NF-κB |
[97,98] |
|
|
BoHV-1 |
Сырой экстракт полисахарид |
LeP(β-D-глюкан) водные (AqE) и этаноловые (EtOHE) экстракты |
Lentinus edodes |
Vitro |
[80] |
|
|
ВБН |
Сырой экстракт |
Метаноловые и н-бутаноловые фракции |
Ganoderma lucidum |
Vitro антинейраминидазная активность |
[99] |
|
|
Полисахарид |
GLP |
Ganoderma lucidum |
Адъювант вакцины |
[100] |
||
|
Полисахарид |
AAP и сулфйатированный полисахарид sAAP |
Auricularia auricula |
Vitro |
[101] |
||
|
Полисахарид |
CMP40, CMP50 |
Cordyceps militaris |
Адъювант вакцины |
[102] |
||
|
Вирусы растений |
ВТМ |
Стероид |
Лейванстеролы A, B |
Omphalia lapidescens |
Vitro |
[103] |
|
Полисахарид |
Кислотный полисахарид BAS-F, содержащий углерод и водород |
Fomes fomentarius |
Полное ингибирование роста инфекции у листьев и полное отсутствие токсического действия |
[104] |
||
|
Полисахарид |
LNT β-(1→3)-связанное основание осадка d-глюкозы, два осадка β-(1→6)-d-гликозила, присоединенные к каждым пяти остаткам d-глюкозы основной цепи |
Lentinus edodes |
Vitro воздействие на близость белковой оболочки ВТМ к хозяину и активация некоторых защитных генов |
[105] |
||
|
ВНПА |
Сырой экстракт |
Смешанный культуральный фильтрат |
Coprinopsis cinerea, Ganoderma lucidum, Lentinula edodes |
Vitro |
[106] |
|
Противовирусная активность
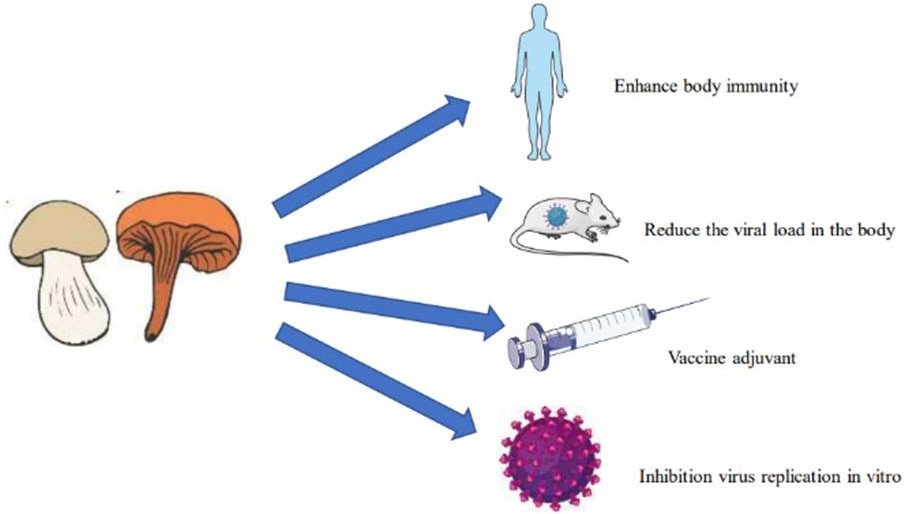
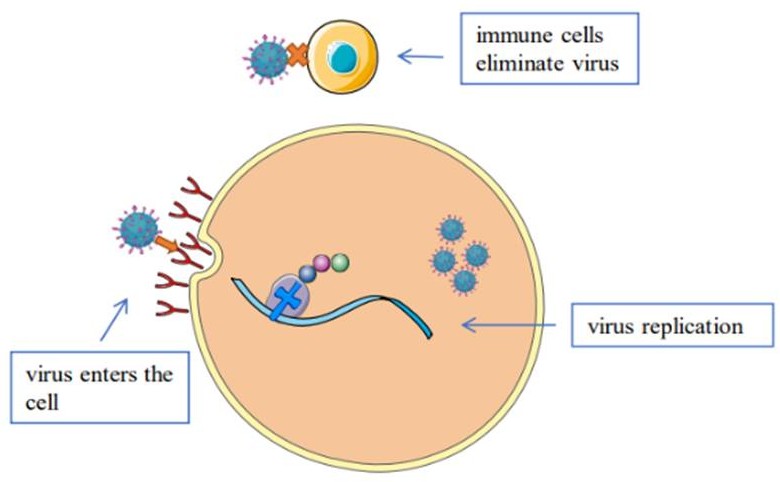
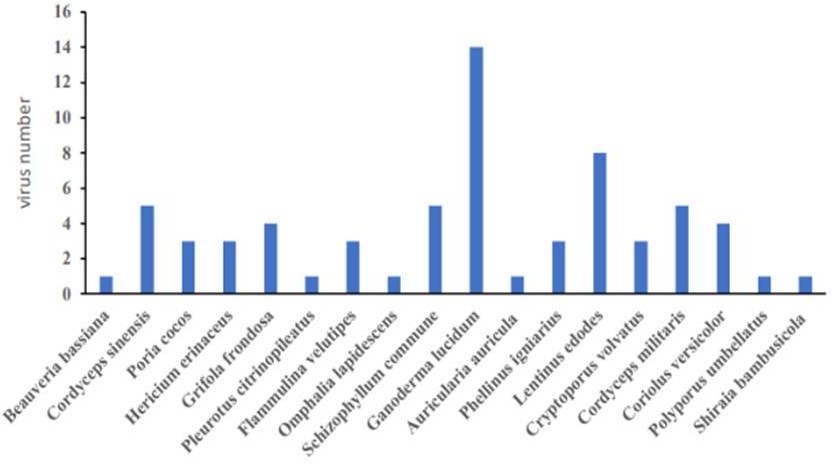
Лекарственные грибы способны бороться с вирусами несколькими способами (Рисунок 1). В настоящее время большинство существующих противовирусных препаратов ингибируют репликацию вирусов в организме. Так как лекарственные грибы содержат сложные компоненты, синергетическое действие нескольких компонентов на вирусы часто имеет неожиданный эффект (Рисунок 2). За последние десятилетия мы систематически подытожили противовирусное действие 18 видов (Рисунок 3) лекарственных грибов со всего мира на различные вирусы. Также мы выявляем источники выделения и противовирусный потенциал активных ингредиентов.

Вирусы человека
SARS-CoV-2
Новая коронавирусная инфекция (COVID-19) представляет собой оболочечный одноцепочечный (+)РНК-содержащий коронавирус семейства Betacoronaviridae [107]. Высокая скорость мутации РНК-содержащего вируса не позволяет быстро справиться с вирусом. С появлением Альфа-, Бета-, Дельта-штаммов вируса, вплоть до Омикрона, появляются все более заразные варианты инфекции, что затрудняет диагностику и контроль заболевания [108]. Поэтому нам как можно скорее необходимо разработать новые противовирусные средства для борьбы с этим заболеванием.
В ходе изучения SARS-CoV-2 на клеточном уровне были протестированы некоторые полисахариды, содержащие L-фукозу, выделенную из Ganoderma lucidum. Было выявлено, что фракция полисахаридов 3 (RF3), содержащая L-фукозу, обладает превосходной противовирусной активностью (2 мкг/мл) и
остается эффективной при разведении в 1280 раз без цитотоксичности [12]. Нарушение соотношения АПФ/АПФ 2 при коронавирусных заболеваниях связано с патологическим механизмом COVID-19. Ингибирующие белки АПФ могут быть выделены из различных лекарственных грибов, в том числе Ganoderma lucidum, Grifola frondosa, Agrocybe species, Auricularia auricula, Hericium erinaceus, Hypsizygus marmoreus, Pleurotus cystidiosus, P. eryngii, P. flabellatus, P. florida, P. sajor-caju, Schizophyllum commune, Tricholoma giganteum, и Volvariella volvaceae. В дополнение к пептидам и протеинам из Ganoderma lucidum были получены тритерпены ингибиторов АПФ. Ингибирование АПФ этих грибов может косвенно восстанавливать соотношение АПФ/АПФ 2, таким образом оказывая терапевтическое воздействие на COVID-19 [13]. Антцины, стероидные соединения лекарственного гриба из Тайваня Antrodia cinnamomea, способны ингибировать АПФ 2 и могут быть использованы в качестве новых анти-АПФ 2 агентов для борьбы с инфекцией SARS-CoV-2 [14].
Полисахариды, содержащиеся в Lentinus edodes, обладают рядом биологических действий и могут оказывать положительное влияние на лечение COVID-19. Полисахарид AHCC, выделяемый из мицелия Lentinus edodes, оказывает лечебный эффект на различные виды вирусных инфекционных заболеваний, такие как вирус Западного Нила, грипп, гепатит и вирус папилломы человека. Это говорит о том, что регуляция иммунной системы играет определенную роль в защите хозяина от респираторной инфекции. Хотя AHCC никогда не тестировался против коронавируса человека, предполагается, что он может оказаться эффективным в лечении COVID-19[15]. Другой полисахарид, IHL, и коммерческий лентинан CL, выделяемые из плодовых тел Lentinus edodes, обладают потенциалом для лечения поражения легких и значительно снижают уровень воспаления в легких. Экстракт CL может уменьшить ранний апоптоз, вызванный оксидативным стрессом, в то время как экстракт IHL способен ингибировать поздний апоптоз. В будущем эти два полисахарида могут уменьшить ущерб, нанесенный вирусной инфекцией, в виде пищевых добавок и продуктов [16]. В последние несколько лет технологии сетевой фармакологии, включая молекулярный докинг и моделирование молекулярной динамики, широко применяются для скрининга препаратов. Verma и др. изучили молекулярное взаимодействие между кордицепином, ключевым компонентом Cordyceps sinensis, и целевым белком, связанным с новым коронавирусом, с помощью моделирования молекулярной динамики. Оказалось, что кордицепин обладает значительной способность связываться RBD доменом спайкового белка коронавируса. Это говорит о том, что кордицепин может быть использован в качестве ингибитора слияния панкоронавирусов, нацеленного на спайковые белки и препятствующего проникновению вируса в организм[17].
Вирус гриппа (IV)
Вирусы гриппа относятся к семейству ортомиксовирусов (Orthomyxoviridae) и имеют сегментированные одноцепочечные РНК-геномы, которые классифицируются на типы A, B и C. Вирус гриппа А является самым распространенным вирусом в мире [109]. Вспышка вируса H1N1 в 2009 году стала одним из наиболее серьезных случаев заболевания за последние несколько лет [110]. В настоящее время вирусы гриппа распространяются сезонно. Самым эффективным способом лечения вируса гриппа считается вакцинация. Однако способность вируса мутировать приводит к необходимости ежегодной вакцинации, что вызывает некоторые неудобства [111].
Obi и др. получили экстракт ME, MF (MF1, MF2 и MF3) из плодовых тел Grifola frondosa. Добавление ME и MF к инфицированным клеткам может повысить их устойчивость к вирусу. Это может быть связано с тем, что экстракты индуцируют производство цитокинов, таких как ФНО-α, которые могут ингибировать рост вируса in vitro [18]. Компоненты Phellinus igniarius также продемонстрировали хорошую противовирусную активность. Два соединения, феллигридины E и G, были получены из метанольного экстракта плодовых тел Phellinus igniarius. Они проявили способность ингибировать нейраминидазу у рекомбинантных H1N1, H3N2 и H5N1 в зависимости от дозировки [19]. Эксперимент in vitro, который включал в себя водный экстракт Phellinus igniarius PIW, показывает, что он оказывает ингибирующее действие по отношению к вирусам пандемического гриппа H1N1 2009 года, человеческого H3N2, птичьего H9N2 и вирусу H1N1, резистентному к осельтамивиру. Его механизм действия может быть связан с вмешательством в процесс ранней репликации вируса [20]. В другом исследовании in vivo и in vitro была отмечена противогриппозная активность LEM, выделенного из мицелия Lentinus edodes. Результаты показали, что LEM может ингибировать рост вируса гриппа in vitro и играть важную роль на ранней стадии, когда вирус проникает в клетки хозяина. Эксперименты in vivo показали, что LEM способен активировать иммунный ответ и ингибировать вирусную инфекцию через путь ИФН I типа [21].
Соединение криптопоровой кислоты E (CAE), выделенное из Cryptoporus volvatus, может ингибировать репликацию вируса гриппа и снижать уровень РНК-содержащего вируса гриппа [22]. Водный экстракт плодового тела Cryptoporus volvatus также эффективен против инфекции H1N1. Результаты показали, что он может снижать уровень вируса в клетках, что в свою очередь может быть связано с целенаправленным ингибированием водным раствором проникновения вируса в клетки. В исследованиях на животных экстракт в большой дозировке полностью защитил мышей от вирусной инфекции [23].
Cordyceps militaris также обладает мощным лечебным действием по отношению к инфекции H1N1. Кислый полисахарид APS был выделен из Cordyceps militaris, культивируемого в пророщенных соевых бобах. Экспериментальное исследование in vivo показало, что APS может значительно снижать титр вируса в легких мышей, повышать иммунитет и снижать смертность при интраназальном введении[24]. Более того, было изучено влияние экстракта Cordyceps militaris на вирус H1N1 у мышей DBA/2. Результаты показали, что экстракт может снизить смертность мышей, инфицированных H1N1, повысить уровни цитокинов, таких как ФНО-α и ИФН-γ, и активировать иммунную систему, способствуя экспрессии ИЛ-12.[25]. Между тем, in vitro была изучена противовирусная активность экстракта мицелия 10 лекарственных грибов по отношению к вирусу H1N1. Исследования Auuriporia aurea, Flammulina velutipes, Fomes fomentarius, Ganoderma lucidum, Lentinus edodes, Lyophyllum shimeji, Pleurotus eryngii, Pleurotus ostreatus, Schizophyllum commune и Trametes versicolor показали, что все 10 видов лекарственных грибов оказывают ингибирующее действие на H1N1. T. Versicolor обладает наиболее мощным противовирусным действием, его терапевтический индекс составляет 324,67 [26].
Некоторые лекарственные грибы способны эффективно бороться с H1N1. DDEA, жирная кислота в составе Cordyceps sinensis, способна уменьшить уровень воспаления, вызванного инфекцией H1N1, а также сократить секрецию воспалительных факторов в клетках. Противовоспалительный эффект достигается путем регуляции иммунных сигнальных путей, активируемых TLR-3, RIG-I и интерфероном типа I[27]. Новый полисахарид PCP-II был получен из Poria cocos. PCP-II в сочетании с вакциной от H1N1 способен значительно увеличить количество антител, способствовать пролиферации В-лимфоцитов и стимулировать гуморальный иммунитет, выработанный с помощью вакцины[28]. Смешанные полисахариды (MP) были получены из грибов шиитаке, Poria cocos, имбиря и сушеной цедры мандарина. В результате перорального приема MP и вакцины они значительно усилили способность мышей противостоять вирусам, уменьшили поражение легких и повысили уровень клеточного и гуморального иммунитета [29]. Противовирусная активность лекарственных грибов может быть также связана с присутствием микроэлементов в их составе. Wang и др. выяснили, что селен, цинк и магний, содержащие в лекарственных грибах способны играть непосредственную или косвенную роль в борьбе с вирусом гриппа [112].
Энтеровирус 71 (EV71)
Эндетровирус 71 - это одноцепочечный РНК-содержащий вирус длиной около 7500 нуклеотидов, он принадлежит к роду энтеровирусов (Enterovirus) семейства пикоравирусов (Picornaviridae) [113]. Вирусная инфекция EV71 может вызывать энтеровирусный везикулярный стоматит, а также серьезные неврологические заболевания, представляющие серьезную угрозу для детей в возрасте до шести лет[114].
Новый гетерополисахарид GFP1 был выделен и очищен из мицелия Grifola frondosa. Результаты клеточных экспериментов in vitro показали, что GFP1 ингибирует цитопатическое действие (CPE), индуцированное EV71, дозозависимым образом. GFP1 ингибировал синтез РНК-содержащего вируса EV71 в клетках Vero дозозависимым образом. Экспрессия полипротеина вируса EV71 была проанализирована с помощью вестерн-блоттинга. Результаты показали, что GFP1 ингибирует экспрессию вирусного VP1 в клетках, инфицированных энтеровирусом 71, и уменьшает апоптоз, индуцированный вирусом EV71, за счет снижения уровня активации каспазы-3[30]. В ходе другого эксперимента с адъювантами вакцины из плодовых тел Ganoderma lucidum был получен и очищен белок-связывающий полисахарид PS-G. In vivo было обнаружено, что сочетание вакцины против EV-A71 для слизистой и PS-G может активировать иммунный ответ и усилить потенциальный ответ иммунных клеток для борьбы с вирусной инфекцией.[31]. Два тритерпеноида, GLTA и GLTB, полученные из Ganoderma lucidum, также продемонстрировали ингибирующее действие по отношению к EV71. Было также обнаружено, что GLTA и GLTB проявляются противовирусную активность по отношению к вирусной инфекции EV71 и при этом не обладают цитотоксичностью. Результаты молекулярного докинга и ПЦР показали, что эти два соединения способны блокировать процесс «раздевания» EV71, ингибируя таким образом вирусную инфекцию[32].
Вирус иммунодефицита человека (ВИЧ)
В начале 1980-х годов как возбудитель синдрома приобретенного иммунодефицита (СПИД) был идентифицирован ретровирус вирус иммунодефицита человека типа 1 (ВИЧ-1) [115]. Геном ВИЧ состоит из двух идентичных положительных нитей РНК с общей длиной приблизительно 9,7 тысяч пар оснований. Антиретровирусная терапия (АРТ) при инфекции ВИЧ-1 является основным методом лечения СПИДа в настоящее время. Она значительно снижает заболеваемость и смертность, вызванные ВИЧ/СПИДом, однако проблема устойчивости к препаратам все еще нуждается в решении[116]. Из плодовых тел Cordyceps sinensis была выделена новая сериновая протеаза кордизобин. Белок обладает очевидной ингибирующей активностью в отношении обратной транскриптазы ВИЧ-1. Значение IC50 составляет 8,2х10–3 мкМ[33]. Способность бороться с ВИЧ in vitro также обнаружена у водных экстрактов из различных частей дикорастущего Cordyceps sinensis. Результаты показали, что пять видов водных экстрактов оказывали дозозависимое ингибирующее действие на вирус ВИЧ-1. Дальнейшие исследования выявили, что их противовирусный эффект может быть связан с активностью обратной транскриптазы ВИЧ-1[34]. Jiang и др. успешно разработали систему скрининга Escherichia coli для предотвращения обратной транскриптазы ВИЧ-1. Из Cordyceps militaris были выделены и очищены три вида аденозина, L3a, L3b и L3c Система скрининга позволила увидеть, что L3a и L3b обладают мощным ингибирующим действием по отношению к обратной транскриптазе ВИЧ-1 [35]. В ходе другого исследования из плодового тела Cordyceps militaris был извлечен лектин, который способен ингибировать активность обратной транкриптазы ВИЧ-1 со значением IC50 10 мкМ [36].
Li и др. получили лектин из Pleurotus citrinopileatus. Лектин оказывает ингибирующее действие на обратную транкриптазу ВИЧ-1 с IC50 в 0,93 мкМ [37]. Кроме этого, из плодовых тел Hypsizigus marmoreus и Flammulina velutipes были получены белки, деактивирующие рибосомы. Оба обладают способностью ингибировать обратную транскриптазу [38,39]. Они также последовательно выделили из плодовых тел Schizophyllum commune и очистили мономер гемолизина с молекулярной массой 29 кДа и рибонуклеазу с молекулярной массой 20 кДа. Они могут ингибировать активность обратной транскриптазы ВИЧ-1. IC50 составляет 1,8 и 65 мМ соответственно [40,41].
Два вида сырых экстрактов NGC и AGC были получены из Ganoderma lucidum и Ganoderma lucidum. Было обнаружено, что оба экстракта могут ингибировать присоединение гликопротеина 120 вируса иммунодефицита человека (ВИЧ-1) (gp120) к кластеру дифференцировки клеток 4 (CD4), при этом AGC обладает более мощным ингибирующим воздействием на gp120 ВИЧ-1, чем NGC [42]. Было обнаружено, что не только сырой экстракт, но и тритерпеноиды в Ganoderma lucidum способны эффективно ингибировать активность обратной транскриптазы ВИЧ-1. Молекулярный докинг показывает, что ганодериновая кислота B способна надежно прикрепиться к протеазе ВИЧ-1. Протеаза ВИЧ-1 в целом является подходящей мишенью для ганодериновой кислоты B. Лечение СПИДа на основе этого соединения имеет большой потенциал[43]. Пять тритерпенов типа ланостеранов, выделенные из спор Ganoderma lucidum, ганодериновая кислота β, люцидумол B, ганодерманондиол, ганодерманонтриол и ганолуцидовая кислота A могут ингибировать активность обратной транскриптазы ВИЧ-1 со значениями IC50 20, 50, 90, 70 и 70 мкМ[44]. Было обнаружено, что ганодериол F и ганодеманонтриол, полученные из метанольного экстракта плодовых тел Ganoderma lucidum, обладают анти-ВИЧ-1 активностью с ингибирующей концентрацией 7,8 мкг/мл. А ганодериновая кислота B, ганодериол B, ганодериновая кислота C1, 3b-5a-дигидрокси-6b-метоксиэргоста-7,22-диен, ганодериновая кислота a, ганодериновая кислота H и ганодериол A способны ингибировать активность обратной транскриптазы ВИЧ-1 с 50%-ной ингибирующей концентрацией 0,17–23 мМ[45].
Кроме того, полисахаридный пептид (PSP), выделенный из Coriolus versicolor, может ингибировать активность обратной транскриптазы ВИЧ-1 с IC50 6,25 мкг/мл. Ингибирование взаимодействия ВИЧ-lgp120 с рецептором CD4 составляет 1,5 мкМ[46]. Дальнейшие эксперименты выявили, что его противовирусный механизм может быть связан со снижением репликации вируса и стимулированием секреции специфических противовирусных хемокинов [47]. При изучении распространенного лекарственного гриба Lentinus edodes из его плодовых тел были получены белок лентин и лакказа с молекулярной массой 67 кДа. Они продемонстрировали ингибирующую активность в отношении обратной транскриптазы ВИЧ-1 со значениями IC50 7,5 мкМ и 1,5 мкМ соответственно.[48,49]. Кроме того, EPS4, водорастворимый лигнин, полученный из мицелия Lentinus edodes, полностью ингибировал цитопатическое действие, индуцированное ВИЧ-1, при концентрации более 10 мкг/мл. Водные экстракты E-P-LEM и LEM способны блокировать цитопатическое действие и экспрессию специфических антигенов, индуцированных ВИЧ [50,51].
Вирус папилломы человека (ВПЧ)
Вирус папилломы человека представляет собой ДНК-содержащий вирус с двухцепочечным закрытым кольцевым геномом и безоболочечным икосаэдрическим капсидом размером около 8 т.п.н. Инфекция ВПЧ может привести к различным видам онкологических заболеваний, включая рак шейки матки, рак полового члена, рак анального канала, рак влагалища, рак вульвы и рак ротоглотки [117]. Вакцинация от ВПЧ и регулярные медицинские осмотры являются основными способами предотвращения заражения ВПЧ [118]. В настоящее время не существует препарата для лечения ВПЧ, его обычно лечат интерфероном. По этой причине разработка специфического препарата от ВПЧ вызывает большой интерес.
В ходе клинических испытаний порошок плодовых тел Trametes versicolor и Ganoderma lucidum помещали в капсулы для перорального приема пациентами с ВПЧ; 87,8% пациентов вылечились. Эти результаты подтверждают лечебные свойства двух видов грибов и закладывают основу для дальнейших исследований [52]. В предварительном исследовании с участием женщин без симптомов применение вагинального геля на основе Trametes versicolor в течение 12 дней значительно улучшило состав микрофлоры влагалища, способствуя улучшению состояния эпителия шейки матки и здоровья влагалища [53]. Другое исследование показывает эффективность использования геля для лечения ВПЧ-положительных пациентов [119].
Вирус денге (DENV)
Вирус денге - это арбовирус, переносчиком которого для людей являются преимущественно желтолихорадочные комары Aedes aegypti. Он имеет четыре различных серотипа: DENV-1, DENV-2, DENV-3 и DENV-4. Наиболее распространенным является DENV-2[120,121]. Лихорадка денге несет серьезную угрозу общественному здравоохранению. Ежегодно она поражает от 100 до 400 миллионов человек, больше всего страдают тропические и субтропические регионы [122].
Обработка комаров Aedes aegypti спорами Beauveria bassiana может в значительной степени ингибировать репликацию вируса денге в средней кишке комаров, что отчасти связано с иммунной активацией эффекторных генов, контролируемых путями Toll и JAK-STAT [54]. Panya и др. обнаружили, что кордицепин может ингибировать репликацию DENV и снижать уровень РНК-содержащего вируса в клетках Vero. Его противовирусный эффект связан с репликацией вирусной РНК на более поздних стадиях вирусной инфекции.[55]. В ходе другого исследования пять видов лекарственных грибов, Lignosus rhinocerotis, Pleurotus giganteus, Hericium erinaceus, Schizo- phyllum commune и Ganoderma lucidium, экстрагировали горячим водным раствором и этанолом, а затем поочередно экстрагировали н-гексаном, этилацетатом и водой. Активность экстракта против вируса денге оценивалась с помощью теста на уменьшение зубного налета. Результаты показали, что горячие водные экстракты и водорастворимые экстракты L. rhinocertis, P. giganteus, H. erinaceus и S. commune обладают наименьшей токсичностью по отношению к клеткам Vero и проявляют значительную активность против DENV-2 [56]. Терапевтическое действие вышеуказанных экстрактов на воспаление, вызванное вирусом денге, было изучено дополнительно. Результаты показали, что горячие водные экстракты G. lucidium, S. commune, P. giganteus и водорастворимые экстракты L. rhinocerotis успешно подавляют производство цитокинов в моноцитах, инфицированных лихорадкой денге [57].
Ингибирующая активность экстракта Ganoderma lucidum по отношению к протеазе DENV NS2B-NS3 была отмечена в двух других исследованиях. Результаты показали, что степень ингибирования водным экстрактом протеазы DENV2 NS2B-NS3 составила 84,6±0,7%. Основным компонентом экстракта по данным ЖХ-МС являлся гесперидин. Методами молекулярного докинга и теорией функционала плотности доказано, что гесперидин является эффективным ингибитором протеазы NS2B-NS3 [58]. Bharadwaj и др. провели скрининг ингибирующей активности тритерпенов из Ganoderma lucidum по отношению к протеазе DENVNS2B-NS3 путем молекулярного докинга и получили 22 вида тритерпеноидов, среди них, например, ганодерманотриол. Затем активность полученных компонентов была оценена in vitro. Эксперимент по заражению вирусом in vitro показал, что ганодерманотриол является перспективным биоактивным тритерпеном [59].
Вирусы гепатита (HV)
В настоящее время в мире наиболее распространены пять видов вирусов гепатита. Это вирус гепатита А (HAV), вирус гепатита B (HBV), вирус гепатита C (HCV), вирус гепатита D (HDV) и вирус гепатита E (HEV). HBV является ДНК-содержащим вирусом, в то время как остальные - РНК-содержащие. Гепатиты B и C, вызванные вирусом гепатита, обладают наиболее высокой смертностью. Если хронический гепатит, вызванный вирусной инфекцией, не лечить вовремя, он приведет к развитию рака печени.
Вирус гепатита B (HBV)
Капсула корбрин, приготовленная из экстракта Cordyceps sinensis, может уменьшить апоптоз клеток почечного эпителия, индуцированный белком HBX, вызванным инфекцией вируса гепатита B. Механизм действия заключается в ингибировании апоптоза клеток HK-2, усиленного HBX, путем ингибирования пути PI3K/Akt/Bcl-2 [60]. Эксперименты на клетках показали, что GF-D, выделенный Gu и др. из Grifola frondosa, оказывает ингибирующее действие на HBV и обладает синергетическим эффектом в сочетании с интерфероном человека α-2b. Противовирусный механизм GF-D может заключаться в непосредственном воздействии на репликацию HBV на уровне ДНК-полимеразы [61]. Большое количество клинических данных, собранных в ходе другого исследования, показывают, что полисахариды Polyporus umbellatus (PUPS) отдельно или в сочетании с интерфероном и другими препаратами могут лечить гепатит, вызванный HBV[62].
Более того, полисахарид сизофиран (SPG), выделенный из Schizophyllum commune, способен регулировать клеточный и гуморальный иммунный ответ нуклеокапсидного антигена у больных хроническим гепатитом В и повышать количество антител [63]. Li и др. обнаружили, что Ganoderma lucidum и водный экстракт коферментированного бульона Radix Sophorae flavescentis могут значительно стимулировать борьбу организма с вирусом гепатита B in vitro и усилить его гепатопротекторную активность для уменьшения поражения печени по сравнению с простой смесью этих двух ингредиентов [64]. Ганодериновая кислота также может ингибировать внутриклеточную репликацию HBV и снижать активность аланинаминотрансферазы и аспартатаминотрансферазы (АЛТ и АСТ) в сыворотке для защиты от поражения печени [65]. Zhao и др. оптимизировали процесс ультразвуковой экстракции лентинана. Два вида полисахаридов, LEP-1 и LEP-2, были получены с помощью оптимизированного метода ультразвуковой экстракции. Исследование in vitro показало, что оба полисахарида негативно влияют на вирус гепатита B [66].
Вирус гепатита С (HСV)
Команда Matsuhisa обнаружила, что экстракт мицелия Lentinula edodes (MSCE) и его главный активный компонент, низкомолекулярный лигнин (LM-лигнин), могут ингибировать попадание псевдовируса HCV (HCVpv) в клетки, а LM-лигнин ингибирует проникновение HCVpv в концентрации ниже, чем MSCE [67]. Вид капсулы Cordyceps militaris (CM) способен ингибировать репликацию РНК HCV RNA in vitro. Дальнейшие исследования показали, что кордицепин является главным активным компонентом CM, предотвращающим развитие HCV. Действие кордицепина связано с его способностью ингибировать полимеразу NS5B [68].
Вирусы герпеса (HV)
Вирус герпеса - тип вируса с оболочкой и геномом из двухцепочечной ДНК. HV могут быть разделены на три типа: α-герпесвирус, β-герпесвирус и γ-герпесвирус. Вирус простого герпеса 1 типа (ВПГ-1) и вирус простого герпеса 2 типа (ВПГ-2) являются наиболее распространенными, оба принадлежат группе α-герпесвирусов. ВПН-1, как правило, вызывает появления инфекций на лице или в ротовой полости, в то время как ВПГ-2 связан с развитием генитального герпеса. Вирус Эпштейна-Барр (ВЭБ) относится к γ-герпесвирусам. Инфекция ВЭБ может вызвать появление рака носоглотки [123,124].
Вирус простого герпеса (ВПГ)
Новый белок Grifola frondosa GFAHP может ингибировать репликацию ВПГ-1 in vitro. Значение IC50 составляет 4.1 мкг/мл, а терапевтический индекс превышает 29,3. Эксперименты in vivo показали, что GFAHP может смягчать воспалительную реакцию у мышей и уменьшать производство вируса in vivo [69]. Экстракт мицелия Lentinus edodes JLS-S001 также способен значительно ингибировать поражение клеток ВПГ-1. Это может быть связано с тем фактом, что JLS-S001 блокирует репликацию ВПГ-1 на более поздней стадии цикла репликации вируса [70]. В ходе другого эксперимента кислый полисахарид, связывающий белок, APBP был получен из плодовых тел Ganoderma lucidum. Он продемонстрировал противовирусную активность по отношению и к ВПГ-1, и к ВПГ-2. EC50 APBP составили 300 и 440 мг/мл соответственно. Противовирусная активность APBP может быть связана с ингибированием прикрепления ВПГ и его проникновения в клетки Vero [71]. Дальнейшие исследования были проведены с целью изучить эффективность APBP в сочетании с распространенными противовирусными препаратами. Вместе с интерфероном APBP продемонстрировал синергетическое действие на вирус [72]. APBP в сочетании с ацикловиром (ACV) и аденозин-арабинозидом (ara-A) демонстрирует синергетическое действие на ВПГ-1. С другой стороны, APBP вместе с ACV оказывает синергетическое действие на ВПГ-2, в то время как сочетание с ara-A дает антагонистический эффект по отношению к ВПГ-2 [73].
Кроме того, сырые экстракты различных лекарственных грибов также влияют на ВПГ. Два вида водорастворимых экстрактов, GLhw and GLlw, и восемь видов метанолорастворимых экстрактов GLMe-1-8 были получены из Ganoderma lucidum. Эксперимент in vitro показал, что GLhw, GLMe-1, GLMe-2, GLMe-4,и GLMe-7 могут в значительной степени ингибировать цитопатическое действие ВПГ [74]. WTTCGE, растительная смесь, содержащая Ganoderma lucidum, может улучшать симптомы больных генитальным герпесом и герпесом губ,
а также сократить период восстановления пациентов [75]. Результаты недавних экспериментов позволяют предположить, что анти-ВПГ-1 активностью обладают метанольные и водные экстракты 10 видов лекарственных грибов, собранных в Турции. Исследования показали, что водный экстракт Fomes fomentarius, Phellinus igniarius и Porodaedalea pini оказывает мощное антигерпетическое действие [125]. Экстракт мицелия 10 лекарственных грибов был изучен in vitro на предмет воздействия на ВПГ-2. Было обнаружено, что четыре вида грибов Pleurotus ostreatus, Fomes fomentarius, Auriporia aurea и Trametes versicolor оказывают ингибирующее действие на вирус. Наиболее высоким терапевтическим индексом обладает T. versicolor, он составляет 324,67 [27].
Вирус Эпштейна-Барр (ВЭБ)
Кордицепин может ингибировать вирусную инфекцию, воздействуя на синтез белка вируса путем влияния на ген ВЭБ, а также препятствовать пролиферации опухолевых клеток, вызванных инфекцией ВЭБ, оказывая определенное противоопухолевое действие [76]. Терпеноиды Ganoderma lucidum могут быть использованы в качестве ингибитора антигена ВЭБ. Iwatsuki и др. изучили ингибирующее действие 17 терпеноидов на ранний антиген вируса ЭБ (ВЭБ-EA). Шестнадцать соединений продемонстрировали значительное ингибирующее действие на индукцию ВЭБ-EA [77]. С помощью экспериментов in vitro и исследований молекулярного докинга Zheng обнаружил, что пять тритерпеноидов могут ингибировать активацию антигена ВЭБ и активность теломеразы. Предполагается, что они оказывают терапевтическое действие на рак носоглотки, вызванный вирусом Эпштейна-Барр [78].
Респираторно-синцитиальный вирус (РСВ)
Респираторно-синцитиальный вирус представляет собой одноцепочечный РНК-содержащий вирус, который поражает преимущественно детей грудного возраста со слабым иммунитетом и может вызывать острую инфекцию нижних дыхательных путей [126]. Поскольку заражение РСВ не приводит к формированию длительного иммунитета, у детей и взрослых могут возникать повторные инфекции. В настоящее время единственным лицензированным противовирусным препаратом против РСВ является рибавирин. Однако рибавирин имеет некоторые недостатки, среди них высокая стоимость, неопределенный лечебный эффект, потенциальная токсичность и т. д. [127].
Из Flammulina velutipes был получен иммуномодулирующий белок FIP-fve. Эксперименты in vivo показали, что пероральное введение FIP-fve может значительно снижать вирусные титры РСВ и уровень мРНК в легких мышей, а также снижать секрецию ИЛ-6. FIP-fve может ингибировать репликацию РСВ и воспаление, вызванное РСВ, за счет снижения транслокации NF-κB. [79].
Полиовирус (ПВ)
Полиовирус представляет собой энтеровирус группы пикорнавирусов (Picornaviridae). Геном вируса - это одноцепочечная плюс-цепь РНК длиной около 7500 нуклеотидов [128]. ПВ обычно проникает в центральную нервную систему в результате инфекции, что приводит к необратимому вялому параличу [129].
В одном исследовании изучалась способность водного экстракта AqE, этанольного экстракта EtOHE и лентинана LeP из Lentinus edodes противостоять полиовирусу. Результаты показали, что три экстракта проявляли противовирусную активность и в основном играли ингибирующую роль на ранней стадии вирусной инфекции [80].
Вирус бешенства (ВБ)
Вирус бешенства является РНК-содержащим вирусом. Бешенство, вызванное ВБ-инфекцией, это смертельный и неизлечимый энцефаломиелит. Ежегодно он убивает десятки тысяч людей по всему миру. ВБ обычно паразитирует у диких животных и может передаваться через поврежденную кожу и слизистую оболочку [130]. В настоящее время основным методом лечения бешенства является вакцинация, которая может предотвратить симптомы и смерть в случае оказания своевременного и эффективного лечения [131].
Полисахарид PCP-II, выделенный из Poria cocos, можно использовать в качестве хорошего адъюванта для вакцины против бешенства. PCP-II способен повышать гуморальный иммунитет, специфический к бешенству, клеточный иммунный ответ и стимулировать защитное действие вакцины [81].
Вирус марбург (MARV)
Вирус марбург появился в 1967 году и был впервые обнаружен у африканских зеленых мартышек. MARV является одним из наиболее опасных патогенов для человека в мире. MARV и вирус Эбола (EBOV) принадлежат к филавирусам. Инфекция приводит к повышению температуры, появлению диареи, рвоты и других симптомов; смертность очень высока. В настоящее время не существует эффективного препарата для лечения этого заболевания [132].
Команда Gai успешно сконструировала вирусоподобную частицу (VLP) MARV. Когда полисахарид Poria cocos PCP-II был объединен с VLP MARV, группа PCP-II значительно усилила специфический ответ антител и титр нейтрализующих антител MARV VLP, а также улучшила иммунный уровень у мышей [82]. Защитный эффект PCP-II в сочетании с VLP MARV был дополнительно изучен на приматах макак-резусов. Результаты показали, что VLP MARV вместе с PCP-II обладали превосходной иммуногенностью у макак-резусов [83].
Что касается действия лекарственных грибов на вирус человека, то многие вещества с терапевтическим и противовирусным действием вошли в клинические исследования и коммерческое производство. Ожидается, что CL, коммерческий лентинан, способный лечить поражение легких, будет использоваться в качестве пищевой добавки для регуляции поражения легких, вызванного вирусной инфекцией. Уже упомянутый препарат капсулы корбрин, содержащий экстракт Cordyceps sinensis, оказывает терапевтическое действие на вирусную инфекцию гепатита В. Капсулы Cordyceps militaris способны влиять на репликацию вируса гепатита С. В ходе клинических исследований капсулы, содержащие порошок плодовых тел Trametes versicolor и Ganoderma lucidum оказывают терапевтическое действие на пациентов с ВПЧ во рту. Вагинальный гель на основе Ganoderma lucidum может значительно улучшить клинические симптомы у ВПЧ-положительных пациентов. Полисахариды Polyporus umbellatus (PUPS) способны лечить гепатит, вызванный вирусом гепатита В. Полисахарид сизофиран из Schizophyllum commune (SPG) может скорректировать уровень антител у пациентов с хроническим гепатитом B. WTTCGE, растительная смесь, содержащая Ganoderma lucidum, оказывает положительное влияние на клинические симптомы у пациентов с герпесом.
Вирусы животных
Вирус инфекционного гемопоэтического некроза (IHNV)
Вирус инфекционного гемопоэтического некроза является возбудителем инфекционного гемопоэтического некроза (IHN), который возникает у многих видов лососевых. Это заболевание в значительной степени влияет на индустриальную аквакультуру [133]. Лентинан LNT-I оказывал сильное противовирусное действие на IHNV in vitro. Противовирусный механизм LNT-I связан с непосредственной инактивацией и ингибированием репликации вируса [84].
Реовирус мускусной утки (MDRV)
MDRV обладает высокой патогенностью и может поражать уток, кур и другую домашнюю птицу. После заражения у птицы появляется водянистая диарея, слабость в ногах и другие симптомы. Реовирус мускусной утки оказывает серьезное влияние на птицеводство [134].
Полисахарид HEP, выделенный из плодовых тел Hericium Erinaceus, может эффективно облегчить клинические симптомы и снизить смертность зараженных мускусных уток. Дальнейшие исследования показали, что HEP может усиливать защитную функцию иммунной системы слизистой кишечника, увеличивать количество клеток, связанных с иммунной системой кишечника, и нормализовывать секрецию кишечных sIgA, ИФН-γ и ИЛ-4 для профилактики и лечения инфекции MDRV [85]. Транскриптомный анализ образцов двенадцатиперстной кишки показал, что HEP может регулировать процесс самонаведения лимфоцитов мускусной утки, чтобы противостоять инфекции MDRV [86]. HEP также может уменьшить поражение иммунных органов, вызванное MDRV, и апоптоз [87].
Вирус синдрома белых пятен (WSSV)
Вирус синдрома белых пятен вызывает развитие синдром белых пятен (WSD), который поражает преимущественно креветок и других ракообразных. Смертность в результате этого заболевания довольно высока и составляет 90-100% в течение семи дней после инфицирования. В настоящее время WSSV считается наиболее опасным вирусным патогеном для креветок и многих других ракообразных [135]. β-1,3 глюкан (BG) был получен из Schizophyllum commune. В ходе эксперимента в корм для креветок, зараженных WSSV, был добавлен BG. По сравнению с контрольной группой BG продемонстрировал повышение иммунитета и улучшение показателей выживаемости среди креветок [88].
Вирус иммунодефицита кошек (ВИК)
Вирус иммунодефицита кошек является причиной появления синдрома иммунодефицита у кошек. ВИК обычно передается среди животных через укусы. Смертность в результате ВИК не высокая. В настоящее время вакцина от ВИК способна эффективно предотвратить развитие заболевания[136].
|
В ходе исследования семнадцать видов лекарственных грибов были экстрагированы с помощью воды, этанола и гексана. Ученые изучили ингибирующее действие экстракта на обратную транскриптазу FIV (FIV-rt). Результаты показали, что этанольный экстракт Inonotus obliquus обладает наибольшей активностью. Значение IC50 составило 0,80–0,16 мкг/мл. Этановый экстракт Inonotus obliquus, водный и этанольный экстракт Phellinus igniarius, этанольный экстракт плодовых тел Cordyceps sinensis, гексановые экстракты мицелия Inonotus obliquus, этанольные экстракты Ganoderma lucidum, гексановые экстракты плодовых тел Morchella esculenta и свежие плодовые тела Cordyceps sinensis также показали высокую активность [89]. Кроме того, разновидность коммерчески доступного соединения HELP-TH1 состоит в основном из Ganoderma lucidum, Cordyceps sinensis и Trametes versicolor. Результаты экспериментов in vitro показывают, что HELP-TH1 может снижать нагрузку ВИК [90].
Вирус деформируемого крыла (DWV) и вирус озера Синай (LSV)
DWV и LSV — два распространенных вируса, которые могут заражать медоносных пчел, что может привести к уменьшению их крыльев, а также сократить продолжительность жизни [137]. Основываясь на результатах недавних экспериментов, можно сделать вывод, что добавление экстракта Fomes fomentarius и Ganoderma applanatum в корм для медоносных пчел позволяет значительно снизить титр вирусов DWV и LSV дозозависимым образом [91].
Вирус некроза нервов (NNV)
Вирусный некроз нервов вызывается инфекцией NNV, которая представляет собой заболевание с высокой контагиозностью и смертностью. NNV в основном поражает таких рыб, таких как морской окунь; основными мишенями инфекции являются личинки и молодь. Это заболевание нанесло большой экономический ущерб промышленной аквакультуре [138]. Белок rLZ-8 экстрагировали, экспрессировали и рекомбинировали из Ganoderma lucidum. Противовирусное действие rLZ-8 на рыб, инфицированных NNV, было подтверждено одним экспериментом in vitro и тремя экспериментами in vivo. Результаты показали, что rLZ-8 может активировать иммунную защиту рыб и эффективно бороться с вирусной инфекцией. [91].
Цирковирус свиней 2 типа (ЦВС-2)
ЦВС-2 является широко распространенным среди свиней эпидемическим вирусом. Свиньи, инфицированные ЦВС-2, обычно проявляют симптомы после отнятия от матери, что приводит к серьезному повреждению иммунной системы. В результате всевозможные вторичные заболевания могут стать серьезной угрозой жизни свиней [139].
Liu и др. инокулировали мышей полисахаридной липосомой Ganoderma lucidum Lip-PS, активировав ЦВС-2. По сравнению с только инокуляцией активированного ЦВС-2 комбинированная вакцинация может индуцировать более эффективный специфический иммунный ответ на инфекцию ЦВС-2 [93].
Вирус репродуктивно-респираторного синдрома свиней (ВРРСС)
ВРРСС представляет собой оболочечный РНК-содержащий вирус с положительной цепью, который является патогеном, вызывающим репродуктивно-респираторный синдром свиней (РРСС). После заражения у свиней развиваются нарушения репродуктивной функции и респираторные симптомы. В настоящее время не существует препарата для лечения инфекции РРСС, при этом вирус может распространяться разными путями, и его трудно предотвратить [140]. Из Cryptoporus volvatus были выделены два мономерных соединения: CM-H-L-5 и 5α,8α-эпидиокси-22E-эргоста-6,22-диен-3β-ол. Эксперимент in vitro показал, что эти соединения оказывают негативное влияние на ВРРСС [94,95]. В ходе других исследований in vivo и in vitro был использован водный экстракт плодовых тел Cryptoporus volvatus. Результаты показали, что он оказывает противовирусное действие на инфекцию РРСС. Экстракт преимущественно ингибирует попадание ВРРСС и синтез его РНК. Он способен замедлить репликацию вируса in vivo. Выживаемость свиней увеличилась [96].
Дельта-коронавирус свиней (PDCoV)
PDCoV впервые был обнаружен в образцах фекалий азиатских свиней в 2009 году. PDCoV — это кишечный коронавирус свиней. Клинические симптомы инфекции PDCoV включают диарею, обезвоживание, рвоту и гибель новорожденных поросят. В настоящее время эффективного средства для лечения этой инфекции не существует [141].
Пероксид эргостерола EP был получен из Cryptoporus volvatus. Результаты in vitro показали, что EP может эффективно предотвращать прикрепление и проникновение PDCoV. PDCoV может активировать сигнальный путь p38/MAPK, способствуя репликации, и активировать сигнальный путь NF-κB, чтобы стимулировать экспрессию цитокинов и вызывать воспаление. Лечение с EP может ингибировать активацию p38 и NF-kB, вызванную инфекцией PDCoV [97]. Исследования in vivo показали, что перорально EP может уменьшить патологические проявления инфекции PDCoV и снизить вирусную нагрузку поросят. Этот факт также объясняет терапевтическое действие EP на организм за счет воздействия на сигнальные пути p38/MAPK и NF-κB [98].
Вирус ринотрахеита крупного рогатого скота 1 (BoHV-1)
BoHV-1 - это ДНК-содержащий вирус, классифицируемый как альфа-вирус герпеса. Он является основным патогеном крупного рогатого скота. У инфицированного крупного рогатого скота часто проявляются такие симптомы, как инфекционный ринотрахеит, выкидыши и инфекционный пустулезный вульвовагинит [142]. В ходе экспериментов над BoHV-1 были использованы водный экстракт AqE, этанольный экстракт EtOHE и лентинан LeP Lentinus edodes. Результаты показали, что эти три экстракта проявляют противовирусную активность и в играют преимущественно ингибирующую роль на ранней стадии вирусной инфекции [80].
Вирус болезни Ньюкасла (ВБН)
Вирус болезни Ньюкасла является главной причиной появления болезни Ньюкасла (БН). ВБН, как правило, возникает у кур. Болезнь впервые была обнаружена в 1926 году; для нее характерны высокая смертность и высокая контагиозность. Вакцинация является на сегодняшний день наиболее эффективным методом предотвращения инфекции ВБН [143].
Антинейраминидазная активность ВБН была протестирована с помощью экстрактов различных органических растворимых фракций Ganoderma lucidum. Результаты показали, что фракции от метанола и н-бутанола обладают более сильной антинейраминидазной активностью, что может быть связано с кислым pH экстракта Ganoderma lucidum и влиянием флавоноидов на нейраминидазную активность ВБН [99]. Полисахарид Ganoderma lucidum GLP может в значительной степени способствовать пролиферации лимфоцитов и повышать уровень мРНК интерферона-γ (ИФН-α) in vitro. Эксперименты in vivo показали, что пероральный прием GLP может значительно способствовать пролиферации лимфоцитов и улучшать титр сывороточных антител у кур. Это показывает, что GLP можно использовать в качестве адъюванта в сочетании с вакцинами [100]. Более того, из Auricularia auricula были получены и очищены три вида полисахаридов. После модификации их ингибирующее действие по отношению к ВБН было оценено in vitro. По сравнению с немодифицированными полисахаридами сульфатированные полисахариды значительно увеличили противовирусную активность. Это связано с ролью сульфатированных полисахаридов на ранней, средней и поздней стадиях проникновения вируса в клетки [101]. В исследованиях in vitro и in vivo два полисахарида Cordyceps militaris CMP40 и CMP50 могли стимулировать пролиферацию лимфоцитов, а также повышать титр сывороточных антител и уровни интерферона и ИЛ-4. Ученые предполагают, что CMP40 и CMP50 могут значительно стимулировать иммунное действие вакцины против болезни Ньюкасла; также они могут быть использованы в качестве иммунного адъюванта [102].
Лекарственные грибы могут быть эффективны в борьбе с вирусами животных. Ряд исследований показал, что экстракты лекарственных грибов оказывают значительное влияние на животных. Полисахарид Hericium erinaceus (HEP) может облегчить клинические симптомы и снизить смертность мускусных уток, инфицированных MDRV. β-1,3 глюкан (BG) в Schizophyllum commune может повысить иммунитет креветок, чтобы противостоять WSSV. Экстракты Fomes fomentarius и Ganoderma applanatum могут значительно снизить титр вирусов DWV и LSV у медоносных пчел. Рекомбинантный белок rLZ-8 в Ganoderma lucidum может активировать иммунную защиту рыб и эффективно бороться с вирусной инфекцией. Эргостерол пероксида EP из Cryptoporus volvatus уменьшают патологические проявления, вызванные с инфекцией PDCoV, и снижают вирусную нагрузку у поросят. Полисахарид Ganoderma lucidum GLP и полисахариды Cordyceps militaris CMP40, CMP50 способны значительно улучшить иммунное действие вакцины против болезни Ньюкасла. Эти вещества могут быть использованы в качестве пищевых добавок или средств в ветеринарной практике.
Вирусы растений
Вирус табачной мозаики (ВТМ)
ВТМ представляет собой распространенный РНК-содержащий вирус растений, который поражает табак, томаты и другие сельскохозяйственные культуры. Для растений, инфицированных ВТМ, характерно пожелтение и сморщивание листьев, что негативно влияет на сельскохозяйственную деятельность [144].
Два новых стероидных соединения, лейванстеролы А и В, и три уже известных соединения были выделены из Omphalia lapidescens. Результаты экспериментов in vitro показали, что все пять соединений препятствуют развитию вируса табачной мозаики [103]. Затем был получен полисахарид BAS-F из Fomes fomentarius. После применения BAS-F на листьях табака, инфицированных ВТМ, этот полисахарид смог полностью ингибировать инфекцию на листьях, не оказав токсического действия на само растение [104]. Команда Wang успешно выделила лентинан LNT и модифицировала его до получения сульфатированного лентинана sLNT. Эксперимент, цель которого было ингибирование пролиферации, показал, что и sLNT, и LNT способны замедлить репликацию вируса, при этом ингибирующее действие sLNT оказалось сильнее, чем у LNT. Его механизм может влиять на близость белковой оболочки ВТМ к хозяину и активировать некоторые защитные гены [105].
Вирус некроза почек арахиса (ВНПА)
ВНПА может вызывать поражение ростков бобовых, томатов, перца, картофеля, хлопчатника и других культур, что серьезно ограничивает развитие растениеводства [145].
Было изучено влияние культурального фильтрата, приготовленного из экстрактов мицелия Coprinopsis cinerea, Ganoderma lucidum и Lentinula edodes, на ВНПА in vitro. Результаты показали, что опрыскивание смешанным культуральным фильтратом может снизить количество патологических изменений и титр вируса. Наконец, с помощью анализа ГХ-МС было обнаружено, что сквален, тритерпеноид Ganoderma lucidum, может иметь потенциальный противовирусный эффект [106].
Хотя исследований действия экстрактов лекарственных грибов на вирусы растений проведено немного, результаты проделанных экспериментов указывают на то, что некоторые экстракты лекарственных грибов оказывают значительное терапевтическое действие на больные растения. BAS-F, полисахарид Fomes fomentarius, проявлял значительный ингибирующий эффект по отношению к ВТМ и не оказывал токсического действия. Культуральный фильтрат экстрактов мицелия Coprinopsis cinerea, Ganoderma lucidum и Lentinula edodes может значительно снизить титр ВНПА в растениях. Все полученные данные имеют важное референтное значение для использования экстракта лекарственных грибов в сельском хозяйстве.
3. Заключение
Из нашего обзора видно, что лекарственные грибы представляют собой не только сырые экстракты; отдельные компоненты, такие как белки, полисахариды и терпеноиды, также могут эффективно бороться с вирусной инфекцией. Некоторые из этих лекарственных грибов обладают ингибирующим действием по отношению к различным вирусам (рис. 4). Сложные компоненты тесно связаны с многоцелевым и многоканальным механизмом действия. Всемирная организация здравоохранения (ВОЗ) подтвердила, что традиционная китайская медицина безопасна и эффективна в лечении COVID-19. Некоторые лекарственные грибы, в том числе Poria cocos и Polyporus umbellatus, нашли широкое применение в клинической практике. Благодаря особым свойствам лечебные грибы лучше употреблять в пищу. В настоящее время выращивание лекарственных грибов стало доступнее. Для этого можно не только использовать деревья, но и применять ферментацию мицелия. Несмотря на большие различия в морфологии между плодовым телом и мицелием, разница в содержании различных компонентов незначительна. Кроме того, широкое использование технологии молекулярного докинга и создание соответствующей базы данных значительно упрощают скрининг противовирусных препаратов. Из-за высокого риска экспериментов над вирусами исследования возможны только в лабораториях с уровнем биобезопасности II, III или выше. Это создает большое препятствие для разработки противовирусных препаратов. Использование псевдовируса решает эту проблему, позволяя людям избежать ненужных рисков, существовавших ранее. С другой стороны, при изучении противовирусных препаратов нельзя ограничиваться самим вирусом. Иногда можно заметить пути, по которым вирус реплицируется или проникает в клетку и захватывает цель для борьбы с вирусом. Специфический для COVID-19 препарат Pfizer «Паксловид» (Paxlovid) нацелен на белок-мишень вируса 3CL. Помимо противовирусных препаратов, вакцины, несомненно, являются еще одним способом борьбы с вирусом. Ряд активных компонентов в составе лекарственных грибов способен не только непосредственно бороться с вирусом, но и активировать иммунный ответ организма человека. Использование экстрактов лекарственных грибов в качестве адъювантов вакцин может значительно повысить эффективность вакцины для лучшей борьбы с вирусной инфекцией. От вспышки высокопатогенного птичьего гриппа в 1997 году до тяжелого острого респираторного синдрома (ТОРС) в 2003 году, пандемии гриппа в 2009 году и COVID-19, мы сталкиваемся не только с проблемой распространения вируса. Коинфекция, вызванная совместным действием различных вирусов на организм человека, также является проблемой, которую следует учитывать. Нам еще предстоит раскопать биологический клад лекарственных грибов.
Вклад авторов:
Концептуализация, Ю.Ч. и Г.Ч; написание—первоначальная версия, Ю.Ч.; написание—редактирование, Ю.Ч., Г.Ч. and Цз.Л. Все авторы ознакомились и дали согласие на публикацию этой версии рукописи.
Funding Финансирование:
Исследовательская работа была профинансирована Государственным фондом естественных наук Китая (No. 21877075, 21807066). Авторы также выражают благодарность за финансовую поддержку Ключевой программы исследований и разработок провинции Шаньдун (№ 2019GSF107003).
Заявление Институционального контрольного совета: неприменимо.
Заявление об информированном согласии: неприменимо.
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Библиографический список
- Theves, C.; Biagini, P.; Crubezy, E. The rediscovery of smallpox. Microbiol. Infect. 2014, 20, 210–218. [CrossRef] [PubMed]
- White, K.A.; Enjuanes, L.; Berkhout, B. RNA virus replication, transcription and recombination. RNA Biol. 2011, 8, 182–183. [CrossRef]
- Milpied-Homsi, B.; Moran, E.M.; Phillips, E.J. Antiviral drug allergy. Allergy Clin. N. Am. 2014, 34, 645–662. [CrossRef] [PubMed]
- Izzedine, H.; Launay-Vacher, V.; Deray, G. Antiviral drug-induced nephrotoxicity. J. Kidney Dis. 2005, 45, 804–817. [CrossRef]
- Collado Mateo, D.; Pazzi, F.; Dominguez Munoz, F.J.; Martin Martinez, J.P.; Olivares, P.R.; Gusi, N.; Adsuar, J.C. Ganoderma Lucidum Improves Physical Fitness in Women with Fibromyalgia. Hosp. 2015, 32, 2126–2135.
- Sanodiya, B.S.; Thakur, G.S.; Baghel, R.K.; Prasad, G.; Bisen, P.S. Ganoderma lucidum: A Potent Pharmacological Macrofungus.
Curr. Pharm. Biotechnol. 2009, 10, 717–742. [CrossRef] [PubMed]
- Guo, Y.; Chen, X.; Gong, P. Classification, structure and mechanism of antiviral polysaccharides derived from edible and medicinal Int. J. Biol. Macromol. 2021, 183, 1753–1773. [CrossRef]
- Venturella, G.; Ferraro, V.; Cirlincione, F.; Gargano, M.L. Medicinal Mushrooms: Bioactive Compounds, Use, and Clinical Trials.
Int. J. Mol. Sci. 2021, 22, 634. [CrossRef]
- Teplyakova, T.V.; Ilyicheva, T.N.; Kosogova, T.A.; Wasser, S.P. Medicinal Mushrooms against Influenza Viruses. J. Med. Mushrooms 2021, 23, 1–11. [CrossRef]
- Wasser, S.P. Medicinal Mushrooms in Human Clinical Studies. Part, I. Anticancer, Oncoimmunological, and Immunomodulatory Activities: A Review. J. Med. Mushrooms 2017, 19, 279–317. [CrossRef]
- Muszynska, B.; Grzywacz-Kisielewska, A.; Kala, K.; Gdula-Argasinska, J. Anti-inflammatory properties of edible mushrooms: A Food Chem. 2018, 243, 373–381. [CrossRef] [PubMed]
- Jan, J.T.; Cheng, T.R.; Juang, Y.P.; Ma, H.H.; Wu, Y.T.; Yang, W.B.; Cheng, C.W.; Chen, X.; Chou, T.H.; Shie, J.J.; et al. Identification of existing pharmaceuticals and herbal medicines as inhibitors of SARS-CoV-2 infection. Natl. Acad. Sci. USA 2021, 118, e2021579118. [CrossRef] [PubMed]
- Rahman, M.A.; Rahman, S.; Bashir, N.M.B.; Mia, R.; Hossain, A.; Saha, S.K.; Kakon, A.J.; Sarker, N.C. Rationalization of Mushroom-Based Preventive and Therapeutic Approaches to COVID-19: Review. Int. J. Med. Mushrooms 2021, 23, 1–11. [CrossRef] [PubMed]
- Senthil Kumar, K.J.; Gokila Vani, M.; Hsieh, H.W.; Lin, C.C.; Wang, S.Y. Antcins from Antrodia cinnamomea and Antrodia salmonea Inhibit Angiotensin-Converting Enzyme 2 (ACE2) in Epithelial Cells: Can Be Potential Candidates for the Development of SARS-CoV-2 Prophylactic Agents. Plants 2021, 10, 1736. [CrossRef]
- Di Pierro, F.; Bertuccioli, A.; Cavecchia, I. Possible therapeutic role of a highly standardized mixture of active compounds derived from cultured Lentinula edodes mycelia (AHCC) in patients infected with 2019 novel coronavirus. Minerva Gastroenterol. Dietol. 2020, 66, 172–176. [CrossRef]
- Murphy, E.J.; Masterson, C.; Rezoagli, E.; O’Toole, D.; Major, I.; Stack, G.D.; Lynch, M.; Laffey, J.G.; Rowan, N.J. beta-Glucan extracts from the same edible shiitake mushroom Lentinus edodes produce differential in-vitro immunomodulatory and pulmonary cytoprotective effects—Implications for coronavirus disease (COVID-19) immunotherapies. Total Environ. 2020, 732, 139330. [CrossRef]
- Verma, A.K. Cordycepin: A bioactive metabolite of Cordyceps militaris and polyadenylation inhibitor with therapeutic potential against COVID-19. Biomol. Struct. Dyn. 2020, 40, 3745–3752. [CrossRef]
- Obi, N.; Hayashi, K.; Miyahara, T.; Shimada, Y.; Terasawa, K.; Watanabe, M.; Takeyama, M.; Obi, R.; Ochiai, H. Inhibitory Effect of TNF-alpha Produced by Macrophages Stimulated with Grifola frondosa Extract (ME) on the Growth of Influenza A/Aichi/2/68 Virus in MDCK Cells. J. Chin. Med. 2008, 36, 1171–1183. [CrossRef]
- Kim, J.Y.; Kim, D.W.; Hwang, B.S.; Woo, E.E.; Lee, Y.J.; Jeong, K.W.; Lee, I.K.; Yun, B.S. Neuraminidase Inhibitors from the Fruiting Body of Phellinus igniarius. Mycobiology 2016, 44, 117–120. [CrossRef]
- Lee, S.; Kim, J.I.; Heo, J.; Lee, I.; Park, S.; Hwang, M.W.; Bae, J.Y.; Park, M.S.; Park, H.J.; Park, M.S. The anti-influenza virus effect of Phellinus igniarius extract. Microbiol. 2013, 51, 676–681. [CrossRef]
- Kuroki, T.; Lee, S.; Hirohama, M.; Taku, T.; Kumakura, M.; Haruyama, T.; Nagata, K.; Kawaguchi, A. Inhibition of Influenza Virus Infection by Lentinus edodes Mycelia Extract Through Its Direct Action and Immunopotentiating Activity. Microbiol. 2018, 9, 1164. [CrossRef]
- Gao, L.; Han, J.; Si, J.; Wang, J.; Wang, H.; Sun, Y.; Bi, Y.; Liu, J.; Cao, L. Cryptoporic acid E from Cryptoporus volvatus inhibits influenza virus replication in vitro. Res. 2017, 143, 106–112. [CrossRef] [PubMed]
- Gao, L.; Sun, Y.; Si, J.; Liu, J.; Sun, G.; Sun, X.; Cao, L. Cryptoporus volvatus extract inhibits influenza virus replication in vitro and in vivo. PLoS ONE 2014, 9, e113604. [CrossRef] [PubMed]
- Ohta, Y.; Lee, J.B.; Hayashi, K.; Fujita, A.; Park, D.K.; Hayashi, T. In vivo anti-influenza virus activity of an immunomodulatory acidic polysaccharide isolated from Cordyceps militaris grown on germinated soybeans. Agric. Food Chem. 2007, 55, 10194–10199. [CrossRef] [PubMed]
- Lee, H.H.; Park, H.; Sung, G.H.; Lee, K.; Lee, T.; Lee, I.; Park, M.S.; Jung, Y.W.; Shin, Y.S.; Kang, H.; et al. Anti-influenza effect of Cordyceps militaris through immunomodulation in a DBA/2 mouse model. Microbiol. 2014, 52, 696–701. [CrossRef]
- Krupodorova, T.; Rybalko, S.; Barshteyn, V. Antiviral activity of Basidiomycete mycelia against influenza type A (serotype H1N1) and herpes simplex virus type 2 in cell culture. Sin. 2014, 29, 284–290. [CrossRef]
- Li, R.F.; Zhou, X.B.; Zhou, H.X.; Yang, Z.F.; Jiang, H.M.; Wu, X.; Li, W.J.; Qiu, J.J.; Mi, J.N.; Chen, M.; et al. Novel Fatty Acid in Cordyceps Suppresses Influenza A (H1N1) Virus-Induced Proinflammatory Response Through Regulating Innate Signaling ACS Omega 2021, 6, 1505–1515. [CrossRef]
- Wu, Y.; Li, S.; Li, H.; Zhao, C.; Ma, H.; Zhao, X.; Wu, J.; Liu, K.; Shan, J.; Wang, Y. Effect of a polysaccharide from Poria cocos on humoral response in mice immunized by H1N1 influenza and HBsAg vaccines. J. Biol. Macromol. 2016, 91, 248–257. [CrossRef]
- Zhu, H.; Hu, M.; Wang, D.; Xu, G.; Yin, X.; Liu, X.; Ding, M.; Han, L. Mixed polysaccharides derived from Shiitake mushroom, Poriacocos, Ginger, and Tangerine peel enhanced protective immune responses in mice induced by inactivated influenza vaccine. Pharm. 2020, 126, 110049. [CrossRef]
- Zhao, C.; Gao, L.; Wang, C.; Liu, B.; Jin, Y.; Xing, Z. Structural characterization and antiviral activity of a novel heteropolysaccha- ride isolated from Grifola frondosa against enterovirus 71. Polym. 2016, 144, 382–389. [CrossRef]
- Lin, Y.L.; Shih, C.; Cheng, P.Y.; Chin, C.L.; Liou, A.T.; Lee, P.Y.; Chiang, B.L. A Polysaccharide Purified from Ganoderma lucidum Acts as a Potent Mucosal Adjuvant That Promotes Protective Immunity Against the Lethal Challenge with Enterovirus A71. Immunol. 2020, 11, 561758. [CrossRef] [PubMed]
- Zhang, W.; Tao, J.; Yang, X.; Yang, Z.; Zhang, L.; Liu, H.; Wu, K.; Wu, J. Antiviral effects of two Ganoderma lucidum triterpenoids against enterovirus 71 infection. Biophys. Res. Commun. 2014, 449, 307–312. [CrossRef] [PubMed]
- Wang, S.X.; Liu, Y.; Zhang, G.Q.; Zhao, S.; Xu, F.; Geng, X.L.; Wang, H.X. Cordysobin, a novel alkaline serine protease with HIV-1 reverse transcriptase inhibitory activity from the medicinal mushroom Cordyceps sobolifera. Biosci. Bioeng. 2012, 113, 42–47. [CrossRef] [PubMed]
- Zhu, Y.; Ma, L.; Hu, Q.; Li, J.; Chen, Y.; Jia, R.; Shen, S.; Zeng, Y. In Vitro Anti-HIV-1 Activity of Cordyceps sinensis Extracts. Bing Du Xue Bao 2016, 32, 417–422. [PubMed]
- Jiang, Y.; Wong, J.H.; Fu, M.; Ng, T.B.; Liu, Z.K.; Wang, C.R.; Li, N.; Qiao, W.T.; Wen, T.Y.; Liu, F. Isolation of adenosine, iso-sinensetin and dimethylguanosine with antioxidant and HIV-1 protease inhibiting activities from fruiting bodies of Cordyceps Phytomedicine 2011, 18, 189–193. [CrossRef]
- Wong, J.H.; Wang, H.; Ng, T.B. A haemagglutinin from the medicinal fungus Cordyceps militaris. Rep. 2009, 29, 321–327. [CrossRef]
- Li, Y.R.; Liu, Q.H.; Wang, H.X.; Ng, T.B. A novel lectin with potent antitumor, mitogenic and HIV-1 reverse transcriptase inhibitory activities from the edible mushroom Pleurotus citrinopileatus. Biochim Biophys Acta 2008, 1780, 51–57. [CrossRef]
- Wong, J.H.; Wang, H.X.; Ng, T.B. Marmorin, a new ribosome inactivating protein with antiproliferative and HIV-1 reverse transcriptase inhibitory activities from the mushroom Hypsizigus marmoreus. Microbiol. Biotechnol. 2008, 81, 669–674. [CrossRef]
- Wang, H.X.; Ng, T.B. Isolation and characterization of velutin, a novel low-molecular-weight ribosome-inactivating protein from winter mushroom (Flammulina velutipes) fruiting bodies. Life Sci. 2001, 68, 2151–2158. [CrossRef]
- Han, C.H.; Zhang, G.Q.; Wang, H.X.; Ng, T.B. Schizolysin, a hemolysin from the split gill mushroom Schizophyllum commune.
FEMS Microbiol. Lett. 2010, 309, 115–121. [CrossRef]
- Zhao, Y.C.; Zhang, G.Q.; Ng, T.B.; Wang, H.X. A novel ribonuclease with potent HIV-1 reverse transcriptase inhibitory activity from cultured mushroom Schizophyllum commune. Microbiol. 2011, 49, 803–808. [CrossRef] [PubMed]
- Cheng, P.G.; Teoh, T.C.; Rizman-Idid, M. Chemical Compounds and Computational Prediction of Their Inhibitory Effects on the HIV-1 gp120 Receptor by Lingzhi or Reishi Medicinal Mushroom, Ganoderma lucidum (Agaricomycetes), with Antler-Like Morphology of Fruiting Bodies. J. Med. Mushrooms 2021, 23, 63–77. [CrossRef] [PubMed]
- Akbar, R.; Yam, W.K. Interaction of ganoderic acid on HIV related target: Molecular docking studies. Bioinformation 2011, 7, 413–417. [CrossRef] [PubMed]
- Min, B.S.; Nakamura, N.; Miyashiro, H.; Bae, K.W.; Hattori, M. Triterpenes from the spores of Ganoderma lucidum and their inhibitory activity against HIV-1 protease. Pharm. Bull. 1998, 46, 1607–1612. [CrossRef]
- El-Mekkawy, S.; Meselhy, M.R.; Nakamura, N.; Tezuka, Y.; Hattori, M.; Kakiuchi, N.; Shimotohno, K.; Kawahata, T.; Otake, T. Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum. Phytochemistry 1998, 49, 1651–1657. [CrossRef]
- Collins, R.A.; Ng, T.B. Polysaccharopeptide from Coriolus versicolor has potential for use against human immunodeficiency virus type 1 infection. Life Sci. 1997, 60, PL383–PL387. [CrossRef]
- Rodriguez-Valentin, M.; Lopez, S.; Rivera, M.; Rios-Olivares, E.; Cubano, L.; Boukli, N.M. Naturally Derived Anti-HIV Polysaccha- ride Peptide (PSP) Triggers a Toll-Like Receptor 4-Dependent Antiviral Immune Response. Immunol. Res. 2018, 2018, 8741698. [CrossRef]
- Sun, J.; Wang, H.X.; Ng, T.B. Isolation of a laccase with HIV-1 reverse transcriptase inhibitory activity from fresh fruiting bodies of the Lentinus edodes (Shiitake mushroom). Indian J. Biochem. Biophys. 2011, 48, 88–94.
- Ngai, P.H.; Ng, T.B. Lentin, a novel and potent antifungal protein from shitake mushroom with inhibitory effects on activity of human immunodeficiency virus-1 reverse transcriptase and proliferation of leukemia cells. Life Sci. 2003, 73, 3363–3374. [CrossRef]
- Suzuki, H.; Okubo, A.; Yamazaki, S.; Suzuki, K.; Mitsuya, H.; Toda, S. Inhibition of the infectivity and cytopathic effect of human immunodeficiency virus by water-soluble lignin in an extract of the culture medium of Lentinus edodes mycelia (LEM). Biophys. Res. Commun. 1989, 160, 367–373. [CrossRef]
- Tochikura, T.S.; Nakashima, H.; Ohashi, Y.; Yamamoto, N. Inhibition (in vitro) of replication and of the cytopathic effect of human immunodeficiency virus by an extract of the culture medium of Lentinus edodes mycelia. Microbiol. Immunol. 1988, 177, 235–244. [CrossRef] [PubMed]
- Hernandez-Marquez, E.; Lagunas-Martinez, A.; Bermudez-Morales, V.H.; Burgete-Garcia, A.I.; Leon-Rivera, I.; Montiel-Arcos, E.; Garcia-Villa, E.; Gariglio, P.; Madrid-Marina, V.; Ondarza-Vidaurreta, R.N. Inhibitory Activity of Lingzhi or Reishi Medicinal Mushroom, Ganoderma lucidum (Higher Basidiomycetes) on Transformed Cells by Human Int. J. Med. Mushrooms 2014, 16, 179–187. [CrossRef] [PubMed]
- Palacios, S.; Losa, F.; Dexeus, D.; Cortes, J. Beneficial effects of a Coriolus versicolor-based vaginal gel on cervical epithelization, vaginal microbiota and vaginal health: A pilot study in asymptomatic women. BMC Womens Health 2017, 17, 21. [CrossRef] [PubMed]
- Dong, Y.; Morton, J.C., Jr.; Ramirez, J.L.; Souza-Neto, J.A.; Dimopoulos, G. The entomopathogenic fungus Beauveria bassiana activate toll and JAK-STAT pathway-controlled effector genes and anti-dengue activity in Aedes aegypti. Insect Biochem. Mol. Biol. 2012, 42, 126–132. [CrossRef]
- Panya, A.; Songprakhon, P.; Panwong, S.; Jantakee, K.; Kaewkod, T.; Tragoolpua, Y.; Sawasdee, N.; Lee, V.S.; Nimmanpipug, P.; Yenchitsomanus, P.T. Cordycepin Inhibits Virus Replication in Dengue Virus-Infected Vero Cells. Molecules 2021, 26, 3118 [CrossRef]
- Ellan, K.; Thayan, R.; Raman, J.; Hidari, K.; Ismail, N.; Sabaratnam, V. Anti-viral activity of culinary and medicinal mushroom extracts against dengue virus serotype 2: An in-vitro study. BMC Complement. Altern. Med. 2019, 19, 260. [CrossRef]
- Ellan, K.; Thayan, R.; Phan, C.W.; Sabaratnam, V. Anti-inflammatory effect of mushrooms in dengue-infected human monocytes.
Trop. Biomed. 2019, 36, 1087–1098.
- Lim, W.Z.; Cheng, P.G.; Abdulrahman, A.Y.; Teoh, T.C. The identification of active compounds in Ganoderma lucidum var. antler extract inhibiting dengue virus serine protease and its computational studies. Biomol. Struct. Dyn. 2020, 38, 4273–4288. [CrossRef]
- Bharadwaj, S.; Lee, K.E.; Dwivedi, V.D.; Yadava, U.; Panwar, A.; Lucas, S.J.; Pandey, A.; Kang, S.G. Discovery of Ganoderma lucidum triterpenoids as potential inhibitors against Dengue virus NS2B-NS3 protease. Rep. 2019, 9, 19059. [CrossRef]
- He, P.; Lei, J.; Miao, J.N.; Wu, D.; Wang, C. Cordyceps sinensis attenuates HBx-induced cell apoptosis in HK-2 cells through suppressing the PI3K/Akt pathway. J. Mol. Med. 2020, 45, 1261–1269. [CrossRef]
- Gu, C.Q.; Li, J.; Chao, F.H. Inhibition of hepatitis B virus by D-fraction from Grifola frondosa: Synergistic effect of combination with interferon-alpha in HepG2 2.2.15. Res. 2006, 72, 162–165. [CrossRef] [PubMed]
- Guo, Z.; Zang, Y.; Zhang, L. The efficacy of Polyporus Umbellatus polysaccharide in treating hepatitis B in China. Mol. Biol. Transl. Sci. 2019, 163, 329–360. [PubMed]
- Kakumu, S.; Ishikawa, T.; Wakita, T.; Yoshioka, K.; Ito, Y.; Shinagawa, T. Effect of sizofiran, a polysaccharide, on interferon gamma, antibody production and lymphocyte proliferation specific for hepatitis B virus antigen in patients with chronic hepatitis B. J. Immunopharmacol. 1991, 13, 969–975. [CrossRef]
- Li, Y.Q.; Yang, Y.L.; Fang, L.; Zhang, Z.B.; Jin, J.; Zhang, K.C. Anti-hepatitis activities in the broth of Ganoderma lucidum supplemented with a Chinese herbal medicine. J. Chin. Med. 2006, 34, 341–349. [CrossRef] [PubMed]
- Li, Y.Q.; Wang, S.F. Anti-hepatitis B activities of ganoderic acid from Ganoderma lucidum. Lett. 2006, 28, 837–841. [CrossRef] [PubMed]
- Zhao, Y.M.; Yang, J.M.; Liu, Y.H.; Zhao, M.; Wang, J. Ultrasound assisted extraction of polysaccharides from Lentinus edodes and its anti-hepatitis B activity in vitro. J. Biol. Macromol. 2018, 107 Pt B, 2217–2223. [CrossRef]
- Matsuhisa, K.; Yamane, S.; Okamoto, T.; Watari, A.; Kondoh, M.; Matsuura, Y.; Yagi, K. Anti-HCV effect of Lentinula edodes mycelia solid culture extracts and low-molecular-weight lignin. Biophys. Res. Commun. 2015, 462, 52–57. [CrossRef]
- Ueda, Y.; Mori, K.; Satoh, S.; Dansako, H.; Ikeda, M.; Kato, N. Anti-HCV activity of the Chinese medicinal fungus Cordyceps Biochem. Biophys. Res. Commun. 2014, 447, 341–345. [CrossRef]
- Gu, C.Q.; Li, J.W.; Chao, F.; Jin, M.; Wang, X.W.; Shen, Z.Q. Isolation, identification and function of a novel anti-HSV-1 protein from Grifola frondosa. Res. 2007, 75, 250–257. [CrossRef]
- Sarkar, S.; Koga, J.; Whitley, R.J.; Chatterjee, S. Antiviral effect of the extract of culture medium of Lentinus edodes mycelia on the replication of herpes simplex virus type 1. Res. 1993, 20, 293–303. [CrossRef]
- Eo, S.K.; Kim, Y.S.; Lee, C.K.; Han, S.S. Possible mode of antiviral activity of acidic protein bound polysaccharide isolated from Ganoderma lucidum on herpes simplex viruses. Ethnopharmacol. 2000, 72, 475–481. [CrossRef]
- Kim, Y.S.; Eo, S.K.; Oh, K.W.; Lee, C.K.; Han, S.S. Antiherpetic activities of acidic protein bound polysaccharide isolated from Ganoderma lucidum alone and in combinations with interferons. Ethnopharmacol. 2000, 72, 451–458. [CrossRef]
- Oh, K.W.; Lee, C.K.; Kim, Y.S.; Eo, S.K.; Han, S.S. Antiherpetic activities of acidic protein bound polysacchride isolated from Ganoderma lucidum alone and in combinations with acyclovir and vidarabine. Ethnopharmacol. 2000, 72, 221–227. [CrossRef]
- Eo, S.K.; Kim, Y.S.; Lee, C.K.; Han, S.S. Antiviral activities of various water and methanol soluble substances isolated from Ganoderma lucidum. Ethnopharmacol. 1999, 68, 129–136. [CrossRef]
- Hijikata, Y.; Yamada, S.; Yasuhara, A. Herbal mixtures containing the mushroom Ganoderma lucidum improve recovery time in patients with herpes genitalis and labialis. Altern. Complement. Med. 2007, 13, 985–987. [CrossRef]
- Ryu, E.; Son, M.; Lee, M.; Lee, K.; Cho, J.Y.; Cho, S.; Lee, S.K.; Lee, Y.M.; Cho, H.; Sung, G.H.; et al. Cordycepin is a novel chemical suppressor of Epstein-Barr virus replication. Oncoscience 2014, 1, 866–881. [CrossRef]
- Iwatsuki, K.; Akihisa, T.; Tokuda, H.; Ukiya, M.; Oshikubo, M.; Kimura, Y.; Asano, T.; Nomura, A.; Nishino, H. Lucidenic acids P and Q, methyl lucidenate P, and other triterpenoids from the fungus Ganoderma lucidum and their inhibitory effects on Epstein-Barr virus activation. Nat. Prod. 2003, 66, 1582–1585. [CrossRef]
- Zheng, D.S.; Chen, L.S. Triterpenoids from Ganoderma lucidum inhibit the activation of EBV antigens as telomerase inhibitors.
Exp. Ther. Med. 2017, 14, 3273–3278. [CrossRef]
- Chang, Y.C.; Chow, Y.H.; Sun, H.L.; Liu, Y.F.; Lee, Y.T.; Lue, K.H.; Ko, J.L. Alleviation of respiratory syncytial virus replication and inflammation by fungal immunomodulatory protein FIP-fve from Flammulina velutipes. Res. 2014, 110, 124–131. [CrossRef]
- Rincao, V.P.; Yamamoto, K.A.; Ricardo, N.M.; Soares, S.A.; Meirelles, L.D.; Nozawa, C.; Linhares, R.E. Polysaccharide and extracts from Lentinula edodes: Structural features and antiviral activity. J. 2012, 9, 37. [CrossRef]
- Zhang, W.; Cheng, N.; Wang, Y.; Zheng, X.; Zhao, Y.; Wang, H.; Wang, C.; Han, Q.; Gao, Y.; Shan, J.; et al. Adjuvant activity of PCP-II, a polysaccharide from Poria cocos, on a whole killed rabies vaccine. Virus Res. 2019, 270, 197638. [CrossRef] [PubMed]
- Gai, W.; Zheng, X.; Wang, C.; Wang, H.; Zhao, Y.; Wang, Q.; Wong, G.; Zhang, W.; Feng, N.; Qiu, B.; et al. Marburg virus-like particles by co-expression of glycoprotein and matrix protein in insect cells induces immune responses in mice. J. 2017, 14, 204. [CrossRef] [PubMed]
- Weiwei, G.; Xuexing, Z.; Chong, W.; Yongkun, Z.; Qi, W.; Hualei, W.; Gary, W.; Ying, X.; Haijun, W.; Zengguo, C.; et al. Marburg virus-like particles produced in insect cells induce neutralizing antibodies in rhesus macaques. Med. Virol. 2017, 89, 2069–2074. [CrossRef]
- Ren, G.; Xu, L.; Lu, T.; Yin, J. Structural characterization and antiviral activity of lentinan from Lentinus edodes mycelia against infectious hematopoietic necrosis virus. J. Biol. Macromol. 2018, 115, 1202–1210. [CrossRef] [PubMed]
- Wu, Y.; Jiang, H.; Zhu, E.; Li, J.; Wang, Q.; Zhou, W.; Qin, T.; Wu, X.; Wu, B.; Huang, Y. Hericium erinaceus polysaccharide facilitates restoration of injured intestinal mucosal immunity in Muscovy duck reovirus-infected Muscovy ducklings. J. Biol. Macromol. 2018, 107 Pt A, 1151–1161. [CrossRef]
- Liu, Z.; Liao, L.; Chen, Q.; Lin, S.; Luo, Y.; Qin, T.; Li, J.; Wang, Q.; Wu, B.; Huang, Y.; et al. Effects of Hericium erinaceus polysaccharide on immunity and apoptosis of the main immune organs in Muscovy duck reovirus-infected ducklings. J. Biol. Macromol. 2021, 171, 448–456. [CrossRef]
- Liu, Z.; Li, M.; Yan, P.; Zhu, Z.; Liao, L.; Chen, Q.; Luo, Y.; Li, H.; Li, J.; Wang, Q.; et al. Transcriptome analysis of the effects of Hericium erinaceus polysaccharide on the lymphocyte homing in Muscovy duck reovirus-infected ducklings. J. Biol. Macromol. 2019, 140, 697–708. [CrossRef]
- Chang, C.-F.; Su, M.-S.; Chen, H.-Y.; Liao, I.C. Dietary β-1,3-glucan effectively improves immunity and survival of Penaeus monodon challenged with white spot syndrome virus. Fish Shellfish Immunol. 2003, 15, 297–310. [CrossRef]
- Seetaha, S.; Ratanabunyong, S.; Tabtimmai, L.; Choowongkomon, K.; Rattanasrisomporn, J.; Choengpanya, K. Anti-feline immunodeficiency virus reverse transcriptase properties of some medicinal and edible Vet. World 2020, 13, 1798–1806. [CrossRef]
- Forzan, M.; Pacini, M.I.; Bonaccini, P.; Mazzei, M. Antiviral effect of a commercially phytotherapeutic compound against feline immunodeficiency virus. Prod. Res. 2021. [CrossRef]
- Stamets, P.E.; Naeger, N.L.; Evans, J.D.; Han, J.O.; Hopkins, B.K.; Lopez, D.; Moershel, H.M.; Nally, R.; Sumerlin, D.; Taylor, A.W.; et al. Extracts of Polypore Mushroom Mycelia Reduce Viruses in Honey Bees. Rep. 2018, 8, 13936. [CrossRef] [PubMed]
- Kuan, Y.C.; Sheu, F.; Lee, G.C.; Tsai, M.W.; Hung, C.L.; Nan, F.H. Administration of recombinant Reishi immunomodulatory pro- tein (rLZ-8) diet enhances innate immune responses and elicits protection against nervous necrosis virus in grouper Epinephelus Fish Shellfish Immunol. 2012, 32, 986–993. [CrossRef] [PubMed]
- Liu, Z.; Zhu, T.; He, J.; Zhang, Y.; Gu, P.; Qiu, T.; Bo, R.; Hu, Y.; Liu, J.; Wang, D. Adjuvanticity of Ganoderma lucidum polysaccharide liposomes on porcine circovirus type-II in mice. J. Biol. Macromol. 2019, 141, 1158–1164. [CrossRef]
- Ma, Z.; Zhang, W.; Wang, L.; Zhu, M.; Wang, H.; Feng, W.H.; Ng, T.B. A novel compound from the mushroom Cryptoporus volvatus inhibits porcine reproductive and respiratory syndrome virus (PRRSV) in vitro. PLoS ONE 2013, 8, e79333. [CrossRef]
- Wang, J.; Li, G.; Lv, N.; Gao, L.; Cao, L.; Shen, L.; Si, J. Chemical constituents from the fruiting bodies of Cryptoporus volvatus. Pharm. Res. 2016, 39, 747–754. [CrossRef]
- Gao, L.; Zhang, W.; Sun, Y.; Yang, Q.; Ren, J.; Liu, J.; Wang, H.; Feng, W.H. Cryptoporus volvatus extract inhibits porcine reproductive and respiratory syndrome virus (PRRSV) in vitro and in vivo. PLoS ONE 2013, 8, e63767. [CrossRef] [PubMed]
- Duan, C.; Ge, X.; Wang, J.; Wei, Z.; Feng, W.H.; Wang, J. Ergosterol peroxide exhibits antiviral and immunomodulatory abilities against porcine deltacoronavirus (PDCoV) via suppression of NF-kappaB and p38/MAPK signaling pathways in vitro. Immunopharmacol. 2021, 93, 107317. [CrossRef] [PubMed]
- Duan, C.; Wang, J.; Liu, Y.; Zhang, J.; Si, J.; Hao, Z.; Wang, J. Antiviral effects of ergosterol peroxide in a pig model of porcine deltacoronavirus (PDCoV) infection involves modulation of apoptosis and tight junction in the small intestine. Res. 2021, 52, 86. [CrossRef]
- Shamaki, B.U.; Sandabe, U.K.; Ogbe, A.O.; Abdulrahman, F.I.; El-Yuguda, A.D. Methanolic Soluble Fractions of Lingzhi or Reishi Medicinal Mushroom, Ganoderma lucidum (Higher Basidiomycetes) Extract Inhibit Neuraminidase Activity in Newcastle Disease Virus (LaSota). J. Med. Mushrooms 2014, 16, 579–583. [CrossRef]
- Zhang, P.; Ding, R.; Jiang, S.; Ji, L.; Pan, M.; Liu, L.; Zhang, W.; Gao, X.; Huang, W.; Zhang, G.; et al. The adjuvanticity of Ganoderma lucidum polysaccharide for Newcastle disease vaccine. J. Biol. Macromol. 2014, 65, 431–435. [CrossRef]
- Nguyen, T.L.; Chen, J.; Hu, Y.; Wang, D.; Fan, Y.; Wang, J.; Abula, S.; Zhang, J.; Qin, T.; Chen, X.; et al. In vitro antiviral activity of sulfated Auricularia auricula polysaccharides. Polym. 2012, 90, 1254–1258. [CrossRef] [PubMed]
- Wang, M.; Meng, X.; Yang, R.; Qin, T.; Li, Y.; Zhang, L.; Fei, C.; Zhen, W.; Zhang, K.; Wang, X.; et al. Cordyceps militaris polysaccharides can improve the immune efficacy of Newcastle disease vaccine in chicken. J. Biol. Macromol. 2013, 59, 178–183. [CrossRef] [PubMed]
- Yan, H.; Rong, X.; Chen, P.T.; Zhang, X.; Ma, Z.Q. Two new steroids from sclerotia of the fungus Omphalia lapidescens. Asian Nat. Prod. Res. 2014, 16, 265–270. [CrossRef] [PubMed]
- Aoki, M.; Tan, M.; Fukushima, A.; Hieda, T.; Kubo, S.; Takabayashi, M.; Ono, K.; Mikami, Y. Antiviral Substances with Systemic Effects Produced by Basidiomycetes such as Fomes fomentarius. Biotechnol. Biochem. 1993, 57, 278–282. [CrossRef]
- Wang, J.; Wang, H.Y.; Xia, X.M.; Li, P.P.; Wang, K.Y. Inhibitory effect of sulfated lentinan and lentinan against tobacco mosaic virus (TMV) in tobacco seedlings. J. Biol. Macromol. 2013, 61, 264–269. [CrossRef]
- Sangeetha, B.; Krishnamoorthy, A.S.; Renukadevi, P.; Malathi, V.G.; Jeya Sundara Sharmila, D.; Amirtham, D. Antiviral activity of basidiomycetous fungi against Groundnut bud necrosis virus in tomato. Biochem. Physiol. 2020, 166, 104570. [CrossRef]
- Del Rio, C.; Malani, P.N. COVID-19-New Insights on a Rapidly Changing Epidemic. JAMA 2020, 323, 1339–1340. [CrossRef]
- Gao, S.J.; Guo, H.; Luo, G. Omicron variant (B.1.1.529) of SARS-CoV-2, a global urgent public health alert! Med. Virol. 2022, 94, 1255–1256. [CrossRef]
- Pleschka, S. Overview of influenza viruses. Top. Microbiol. Immunol. 2013, 370, 1–20.
- Sullivan, S.J.; Jacobson, R.M.; Dowdle, W.R.; Poland, G.A. 2009 H1N1 influenza. Clin. Proc. 2010, 85, 64–76. [CrossRef]
- Gaitonde, D.Y.; Moore, F.C.; Morgan, M.M.K. Influenza: Diagnosis and Treatment. Fam. Physician 2019, 100, 751–758. [PubMed]
- Wang, L.; Hou, Y. Determination of trace elements in anti-influenza virus mushrooms. Trace Elem. Res. 2011, 143, 1799–1807. [CrossRef] [PubMed]
- Zhang, D.; Lu, J.; Lu, J. Enterovirus 71 vaccine: Close but still far. J. Infect. Dis. 2010, 14, e739–e743. [CrossRef]
- Fowlkes, A.L.; Honarmand, S.; Glaser, C.; Yagi, S.; Schnurr, D.; Oberste, M.S.; Anderson, L.; Pallansch, M.A.; Khetsuriani, N. Enterovirus-associated encephalitis in the California encephalitis project, 1998–2005. Infect. Dis. 2008, 198, 1685–1691. [CrossRef] [PubMed]
- Ortblad, K.F.; Lozano, R.; Murray, C.J. The burden of HIV: Insights from the Global Burden of Disease Study 2010. AIDS 2013, 27, 2003–2017. [CrossRef] [PubMed]
- Yuan, H.; Liu, Z.; Wu, X.; Wu, M.; Fang, Q.; Zhang, X.; Shi, T.; Tully, D.C.; Zhang, T. Prevalence of transmitted HIV-1 drug resistance among treatment-naive individuals in China, 2000–2016. Virol. 2021, 166, 2451–2460. [CrossRef] [PubMed]
- Dunne, E.F.; Park, I.U. HPV and HPV-associated diseases. Dis. Clin. N. Am. 2013, 27, 765–778. [CrossRef]
- Yang, A.; Farmer, E.; Wu, T.C.; Hung, C.F. Perspectives for therapeutic HPV vaccine development. Biomed. Sci. 2016, 23, 75. [CrossRef]
- Criscuolo, A.A.; Sesti, F.; Piccione, E.; Mancino, P.; Belloni, E.; Gullo, C.; Ciotti, M. Therapeutic Efficacy of a Coriolusversicolor- Based Vaginal Gel in Women with Cervical Uterine High-Risk HPV Infection: A Retrospective Observational Study. Ther. 2021, 38, 1202–1211. [CrossRef]
- Salazar, M.I.; Richardson, J.H.; Sanchez-Vargas, I.; Olson, K.E.; Beaty, B.J. Dengue virus type 2: Replication and tropisms in orally infected Aedes aegypti mosquitoes. BMC Microbiol. 2007, 7, 9. [CrossRef]
- Tian, J.N.; Yang, C.C.; Chuang, C.K.; Tsai, M.H.; Wu, R.H.; Chen, C.T.; Yueh, A. A Dengue Virus Type 2 (DENV-2) NS4B-Interacting Host Factor, SERP1, Reduces DENV-2 Production by Suppressing Viral RNA Replication. Viruses 2019, 11, 787. [CrossRef] [PubMed]
- Nanaware, N.; Banerjee, A.; Mullick Bagchi, S.; Bagchi, P.; Mukherjee, A. Dengue Virus Infection: A Tale of Viral Exploitations and Host Responses. Viruses 2021, 13, 1967. [CrossRef] [PubMed]
- Rechenchoski, D.Z.; Faccin-Galhardi, L.C.; Linhares, R.E.C.; Nozawa, C. Herpesvirus: An underestimated virus. Folia Microbio.
2017, 62, 151–156. [CrossRef] [PubMed]
- Widener, R.W.; Whitley, R.J. Herpes simplex virus. Clin. Neurol. 2014, 123, 251–263. [PubMed]
- Dogan, H.H.; Karagoz, S.; Duman, R. In Vitro Evaluation of the Antiviral Activity of Some Mushrooms from Turkey. J. Med. Mushrooms 2018, 20, 201–212. [CrossRef] [PubMed]
- Mammas, I.N.; Drysdale, S.B.; Rath, B.; Theodoridou, M.; Papaioannou, G.; Papatheodoropoulou, A.; Koutsounaki, E.; Koutsaftiki, C.; Kozanidou, E.; Achtsidis, V.; et al. Update on current views and advances on RSV infection (Review). J. Mol. Med. 2020, 46, 509–520. [CrossRef]
- Chatterjee, A.; Mavunda, K.; Krilov, L.R. Current State of Respiratory Syncytial Virus Disease and Management. Dis. Ther.
2021, 10 (Suppl. S1), 5–16. [CrossRef]
- Racaniello, V.R. One hundred years of poliovirus pathogenesis. Virology 2006, 344, 9–16. [CrossRef]
- Nathanson, N. Chapter 1 The Pathogenesis of Poliomyelitis: What We Don’t Know. Virus Res. 2008, 71, 1–50.
- Davis, B.M.; Rall, G.F.; Schnell, M.J. Everything You Always Wanted to Know About Rabies Virus (But Were Afraid to Ask). Rev. Virol. 2015, 2, 451–471. [CrossRef]
- Stitz, L.; Vogel, A.; Schnee, M.; Voss, D.; Rauch, S.; Mutzke, T.; Ketterer, T.; Kramps, T.; Petsch, B. A thermostable messenger RNAbased vaccine against rabies. PLoS Negl. Trop. Dis. 2017, 11, e0006108. [CrossRef] [PubMed]
- Zhang, L.; Lei, S.; Xie, H.; Li, Q.; Liu, S.; Liu, Q.; Huang, W.; Xiao, X.; Wang, Y. Screening and Identification of Marburg Virus Entry Inhibitors Using Approved Drugs. Sin. 2020, 35, 235–239. [CrossRef] [PubMed]
- Dixon, P.; Paley, R.; Alegria-Moran, R.; Oidtmann, B. Epidemiological characteristics of infectious hematopoietic necrosis virus (IHNV): A review. Res. 2016, 47, 63. [CrossRef] [PubMed]
- Chen, X.; Zheng, M.; Huang, M.; Xiao, S.; Lin, F.; Chen, S.; Chen, S. Muscovy Duck Reovirus Infection Disrupts the Composition of Intestinal Microbiota in Muscovy Ducklings. Microbiol. 2020, 77, 769–778. [CrossRef]
- Zheng, S.C.; Xu, J.Y.; Liu, H.P. Cellular entry of white spot syndrome virus and antiviral immunity mediated by cellular receptors in crustaceans. Fish Shellfish Immunol. 2019, 93, 580–588. [CrossRef] [PubMed]
- Kanzaki, L.I.B.; Looney, D.J. Feline immunodeficiency virus: A concise review. Biosci. -Landmark 2004, 9, 370–377. [CrossRef] [PubMed]
- De Miranda, J.R.; Genersch, E. Deformed wing virus. Invertebr. Pathol. 2010, 103 (Suppl. S1), S48–S61. [CrossRef]
- Li, C.; Liu, J.; Zhang, X.; Yu, Y.; Huang, X.; Wei, J.; Qin, Q. Red grouper nervous necrosis virus (RGNNV) induces autophagy to promote viral replication. Fish Shellfish Immunol. 2020, 98, 908–916. [CrossRef]
- Wang, Q.; Zhou, H.; Hao, Q.; Li, M.; Liu, J.; Fan, H. Coinfection with porcine circovirus type 2 and Streptococcus suis serotype 2 enhances pathogenicity by dysregulation of the immune responses in piglets. Microbiol. 2020, 243, 108653. [CrossRef]
- Lunney, J.K.; Fang, Y.; Ladinig, A.; Chen, N.; Li, Y.; Rowland, B.; Renukaradhya, G.J. Porcine Reproductive and Respiratory Syndrome Virus (PRRSV): Pathogenesis and Interaction with the Immune System. Rev. Anim. Biosci. 2016, 4, 129–154. [CrossRef]
- Zhang, J. Porcine deltacoronavirus: Overview of infection dynamics, diagnostic methods, prevalence and genetic evolution. Res. 2016, 226, 71–84. [CrossRef] [PubMed]
- Muylkens, B.; Thiry, J.; Kirten, P.; Schynts, F.; Thiry, E. Bovine herpesvirus 1 infection and infectious bovine rhinotracheitis. Res. 2007, 38, 181–209. [CrossRef] [PubMed]
- Ganar, K.; Das, M.; Sinha, S.; Kumar, S. Newcastle disease virus: Current status and our understanding. Virus Res. 2014, 184, 71–81. [CrossRef] [PubMed]
- Lu, Z.S.; Chen, Q.S.; Zheng, Q.X.; Shen, J.J.; Luo, Z.P.; Fan, K.; Xu, S.H.; Shen, Q.; Liu, P.P. Proteomic and Phosphoproteomic Analysis in Tobacco Mosaic Virus-Infected Tobacco (Nicotiana tabacum). Biomolecules 2019, 9, 39. [CrossRef]
- Sangeetha, B.; Krishnamoorthy, A.S.; Sharmila, D.J.S.; Renukadevi, P.; Malathi, V.G.; Amirtham, D. Molecular modelling of coat protein of the Groundnut bud necrosis tospovirus and its binding with Squalene as an antiviral agent: In vitro and in silico docking investigations. J. Biol. Macromol. 2021, 189, 618–634. [CrossRef]