Мелатонин увеличивает общую выживаемость пациентов с раком предстательной железы с плохим прогнозом после комбинированного гормонального лучевого лечения
АННОТАЦИЯ
Сведения: широко известны противоопухолевые и иммуномодулирующие свойства мелатонина. Эти действия основаны на многофакторном механизме воздействия на различные звенья канцерогенеза. В настоящей работе оценены отдаленные результаты клинического применения мелатонина в комплексном лечении больных раком предстательной железы различных групп риска.
Материалы и методы: ретроспективное исследование включало 955 пациентов с различными стадиями рака предстательной железы (РПЖ), получавших комбинированную лучевую гормональную терапию с 2000 по 2019 год. Для анализа общей выживаемости пациентов с РПЖ, получавших мелатонин, в различных группах прогноза использовались комплексные статистические методы.
Результаты: общая выживаемость пациентов с РПЖ с благоприятным и промежуточным прогнозом, получавших или не получавших мелатонин, статистически значимо не различалась. В группе с плохим прогнозом средняя общая выживаемость у пациентов, принимавших препарат, составила 153,5 месяца по сравнению с 64,0 месяцами у пациентов, не принимавших его (p <0,0001). 5-летняя общая выживаемость в исследовательской и контрольной группах составила 66,8 ± 1,9 и 53,7 ± 2,6 (p <0,0001) соответственно. В многофакторном анализе оказалось, что введение мелатонина является независимым прогностическим фактором и снижает риск смерти пациентов с РПЖ более чем в два раза (p <0,0001).
Выводы: многокомпонентное противоопухолевое действие мелатонина полностью реализуется и наглядно демонстрируется при лечении больных РПЖ с неблагоприятным прогнозом и комплексом неблагоприятных факторов прогрессирования опухоли.
ВВЕДЕНИЕ
Мелатонин - главный гормон шишковидной железы. Он является регулятором циркадного ритма всех живых организмов, обладает антиоксидантным, иммуномодулирующим и противоопухолевым действием [1, 2]. Противоопухолевое действие мелатонина было продемонстрировано как в лабораторных, так и в естественных условиях на ряде экспериментальных моделей на грызунах. Локализация включает молочную железу, толстую кишку, матку, шейку матки, легкие и т.д. [3–5]. Мелатонин наиболее широко используется в клинической практике для лечения гормонозависимых опухолей и, прежде всего, в комбинированном лечении рака груди [6]. Согласно имеющимся данным, применение мелатонина приводило к увеличению количества объективных ответов и/или общей выживаемости пациентов и сопровождалось уменьшением частоты побочных эффектов лекарственной противоопухолевой и лучевой терапии [1, 6, 7].
Некоторые возможные точки ингибирования роста опухоли мелатонином включали активацию Т-хелперов 1 типа; повышенную продукцию нескольких цитокинов (IL-2, IFN-γ, IL-6); угнетение ангиогенеза; снижение экспрессии рецепторов ФРЭС; активация апоптоза в опухолевых клетках; снижение активности теломеразы [1, 6, 8–10].
Рак предстательной железы (РПЖ) - вторая по частоте неоплазия и пятая по значимости причина смертности от рака у мужчин [11]. Работа в ночную смену и свет в ночное время вызывают нарушение циркадного ритма, за которым следует снижение уровня циркулирующего мелатонина, что является одной из возможных причин высокого риска РПЖ [12, 13]. Тем не менее данных о роли мелатонина в профилактике и лечении РПЖ очень мало.
Ряд эпидемиологических исследований показал клиническую эффективность мелатонина в снижении как риска развития РПЖ, так и его агрессивности [1, 14]. Исследования как в лабораторных, так и в естественных условиях демонстрируют различные механизмы ингибирования опухолевой пролиферации клеток аденокарциномы простаты как за счет усиления апоптоза и циторедукции, так и за счет снижения опухолевого потенциала и ангиогенеза [6, 7, 15, 16]. Особый интерес представляют работы, демонстрирующие положительные результаты применения мелатонина в лечении кастраторезистентного метастатического РПЖ, когда возможности большинства доступных препаратов уже исчерпаны. Так, в исследовании П. Лиссони и др. [17, 18] показаны результаты применения препаратов мелатонина в паллиативном лечении пациентов с терминальной стадией рака простаты. Из четырех пациентов у трех мужчин наблюдалась стабилизация заболевания, что позволило им преодолеть двухлетний порог общей выживаемости.
Таким образом, оценка отдаленных результатов широкого клинического применения мелатонина в комплексном лечении больных раком простаты различных групп риска является крайне необходимой и актуальной задачей.
Целью исследования было повышение эффективности лечения больных раком простаты длительным приемом препаратов мелатонина после курса комбинированной гормонально-лучевой терапии.
РЕЗУЛЬТАТЫ
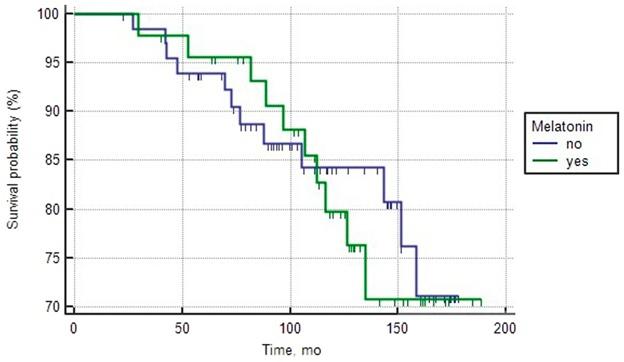
Анализ обеих групп пациентов с благоприятным прогнозом РПЖ, а также обеих групп с промежуточным прогнозом, которые лечились или не лечились мелатонином, выявил как схожие основные клинические и морфологические характеристики, так и среднюю общую выживаемость (Таблицы 1 и 2). Однофакторный анализ и проверка по логранговому критерию не показали статистически значимого влияния потребления мелатонина на выживаемость (Рисунки 1 и 2).
Таблица 1: Клинические характеристики пациентов с раком предстательной железы с благоприятным прогнозом (n = 113)
|
Параметры |
Пациенты, получавшие мелатонин |
Пациенты, лечившиеся без мелатонина |
p |
|
Номер |
46 |
67 |
|
|
Возраст на момент постановки диагноза, лет, Me (IQR) |
66.1 (59.3–70.5) |
63.1 (59.5–70.7) |
> 0.05 |
|
ПСА при диагностике, нг/мл, Me (IQR) |
6.9 (5.6–8.7) |
6.7 (4.5–8.6) |
> 0.05 |
|
Доза ДЛТ, Гр, Me (IQR) |
68.0 (66.0–70.0) |
68.5 (66.0–70.5) |
> 0.05 |
|
Время наблюдения, mo, Me (IQR) |
125.9 (101.6–148.5) |
106.0 (76.6–151.2) |
> 0.05 |
|
Общая выживаемость, Среднее ± SE |
162.9 ± 7.1 |
157.2 ± 5.5 |
> 0.05 |
|
10-летняя Общая выживаемость,% |
79,7 |
84,2 |
> 0.05 |
Таблица 2: Клинические характеристики пациентов с раком предстательной железы с промежуточным прогнозом (n = 187)
|
Параметры |
Пациенты, получавшие мелатонин |
Пациенты, лечившиеся без мелатонина |
p |
|
Номер |
91 |
96 |
|
|
Возраст на момент постановки диагноза, лет, Me (IQR) |
67.0 (61.3–79.6) |
64.6 (60.7–67.9) |
> 0.05 |
|
ПСА при диагностике, нг/мл, Me (IQR) |
16.0 (11.9–18.9) |
15.5 (12.5–18.6) |
> 0.05 |
|
Доза ДЛТ, Гр, Me (IQR) |
68.5 (66.5–70.5) |
68.5 (66.0–71.0) |
> 0.05 |
|
Время наблюдения, mo, Me (IQR) |
110.0 (92.4–136.7) |
93.5 (68.6–128.6) |
> 0.05 |
|
Общая выживаемость, Среднее ± SE |
170.0.9 ± 7.2 |
167.9 ± 10.1 |
> 0.05 |
|
10-летняя Общая выживаемость,% |
68,3 |
64,1 |
> 0.05 |
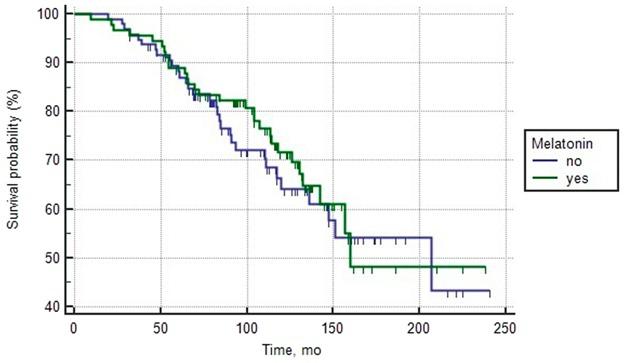
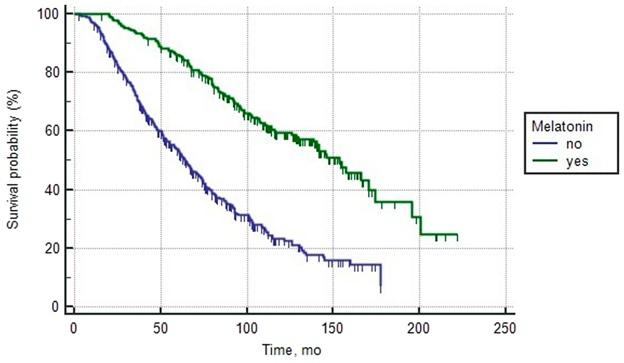
Общая клинико-морфологическая характеристика пациентов с неблагоприятным прогнозом рака простаты представлена в Таблице 3. Однофакторный анализ показал, что исходный уровень ПСА, сумма баллов по шкале Глисона, потребление мелатонина, наличие клинически положительных региональных лимфатических узлов, время удвоения ПСА перед лечением (ВУПСА) и количество локализаций метастатических очагов оказали значительное влияние на Общую выживаемость. Чтобы уменьшить их независимую прогностическую значимость, был проведен многофакторный анализ пропорциональных рисков Кокса и использован метод принудительного проникновения. Многофакторная модель включала следующие количественные (ПСА до лечения и ВУПСА) и категориальные независимые факторы: клинически положительные тазовые лимфатические узлы (N0/N1); Шкала Глисона низкий ШГ (6–7)/средний ШГ (8)/высокий ШГ (9–10); потребление мелатонина (да/нет) и количество очагов метастазирования (1 участок/2 участка/3 участка). Результаты многофакторного анализа представлены в Таблице 4. Включение морфологических факторов в многомерную модель показало, что независимыми предикторами риска смерти были сумма Глисона по данным биопсии 8 и 9–10, наличие отдаленных метастазов и отсутствие приема мелатонина. Наиболее сильное влияние на снижение выживаемости, естественно, оказали следующие неблагоприятные факторы: наличие трех локализаций метастатических очагов (Ma+b+c), а также сумма баллов по шкале Глисона 9-10 (Exp (b) = 5,2 и 3,0 соответственно). Риск смерти у пациентов с РПЖ был более чем вдвое выше при наличии двух метастазов и отсутствии приема мелатонина (Exp (b) = 2,5 и 2,2, соответственно). На Рисунке 3 представлены кривые общей выживаемости контрольной и исследовательской групп пациентов с неблагоприятным прогнозом РПЖ, сформированные в зависимости от приема мелатонина. Средняя общая выживаемость у пациентов, получавших препарат, составила 153,5 месяца по сравнению с 64,0 месяцами у пациентов, которые не лечились препаратами. 5-летняя общая выживаемость в группе лечения мелатонином и в контрольной группе составила 66,8 ± 1,9 и 53,7 ± 2,6 соответственно.
Таблица 3: Клинико-морфологические характеристики пациентов с раком предстательной железы с плохим прогнозом (n = 655)
|
Параметры |
Пациенты, получавшие мелатонин |
Пациенты, лечившиеся без мелатонина |
p |
|
Номер |
259 |
396 |
|
|
Возраст на момент постановки диагноза, лет, Me (IQR) |
65.0 (58.8–71.7) |
64.5 (59.6–69.4) |
> 0.05 |
|
ПСА при диагностике, нг/мл, Me (IQR) |
33.5 (19.0–53.0) |
43.9 (29.9–85.6) |
< 0.01 |
|
ВУПСА перед лечением, мес., Me (IQR) |
21.7 (8.2–48.8) |
16.0 (4.6–38.7) |
< 0.05 |
|
Биопсия по шкале Глисона, n (%) |
|||
|
6–7 |
126 (48.6) |
180 (45.5) |
> 0.05 |
|
8 |
112 (43.2) |
153 (38.6) |
> 0.05 |
|
9–10 |
21 (8.1) |
63 (15.9) |
< 0.01 |
|
Клинически положительные лимфатические узлы, n (%) |
69 (26.6) |
141 (35.6) |
< 0.05 |
|
Количество метастатических очагов, n (%) |
|||
|
1 (M1a or 1b or 1c) |
110 (42.5) |
196 (49.5) |
> 0.05 |
|
2 (M1a+b or 1a+c or 1b+c) |
9 (3.5) |
24 (6.1) |
< 0.01 |
|
3 (M1a+b+c) |
6 (2.3) |
12 (3.0) |
> 0.05 |
|
5-летняя Общая выживаемость,% |
66.8 ± 1.9 |
53.7 ± 2.6 |
< 0.0001 |
Таблица 4: Результаты многомерного анализа
|
Независимая переменная |
b |
SE |
Вальд |
p |
Exp (b) |
95% CI of Exp (b) |
|
средний ШГ (8) |
0,3897 |
0,1469 |
7,0348 |
0,0080 |
1,4766 |
1,1071 - 1,9694 |
|
высокий ШГ (9–10) |
1,1064 |
0,1998 |
30,6510 |
< 0.0001 |
3,0234 |
2,0436 - 4,4731 |
|
1 очаг метастазирования |
0,4583 |
0,1474 |
9,6705 |
0,0019 |
1,5814 |
1,1847 - 2,1111 |
|
2 очага метастазирования |
0,9099 |
0,4022 |
5,1176 |
0,0237 |
2,4841 |
1,1293 - 5,4644 |
|
3 очага метастазирования |
1,6538 |
0,4451 |
13,8055 |
0,0002 |
5,2266 |
2,1845 - 12,5052 |
|
Мелатонин - нет |
0,7932 |
0,1449 |
29,9746 |
< 0.0001 |
2,2105 |
1,6640 - 2,9364 |
ОБСУЖДЕНИЕ
Анализ общей выживаемости пациентов с РПЖ как с благоприятным, так и с промежуточным прогнозом не выявил существенных различий в зависимости от длительного приема препаратов мелатонина. Эти категории пациентов после радикального лечения имели высокие показатели эффективности рака и характеризовались длительной общей выживаемостью (медиана общей выживаемости не была достигнута ни в одной из групп со средним периодом наблюдения более 10 лет). Тот факт, что современные методы лучевой и гормональной терапии у пациентов с местным и высокодифференцированным РПЖ очень эффективны, полностью подавляют опухолевый процесс, обеспечивая отличные клинические результаты, и может объяснить отсутствие значительного влияния мелатонина на продолжительность жизни этих пациентов. Когда на фоне лечения достигается полный местный ответ, физически отсутствуют условия и точки приложения для реализации противоопухолевого действия мелатонина.
В группе пациентов с неблагоприятным прогнозом картина противоположная. Многосторонний статистический анализ продемонстрировал явный положительный эффект от введения мелатонина на долгосрочную выживаемость. При 5-летнем среднем наблюдении пациенты, получавшие мелатонин, имели общую выживаемость, которая в среднем была на 13 месяцев больше по сравнению с контрольной группой. Этот вывод был подтвержден многофакторным анализом, в котором лечение мелатонином служило независимым прогностическим фактором и снижало риск смерти у пациентов с РПЖ более чем в 2 раза.
В трех исследованиях агрессивность РПЖ оценивалась по шкале Глисона с помощью диагностической биопсии. Эти три исследования показывают сильную связь с прогнозом. Риски, связанные с работой в ночную смену, были выше среди агрессивных опухолей по сравнению с менее агрессивными опухолями [12]. Мужчины, которые никогда не работали в ночное время и в ночную смену, не имеют меньшего риска РПЖ по сравнению с работниками ночной смены [12]. Можно предположить, что у пациентов с РПЖ с плохим прогнозом уровень мелатонина ниже.
Современные варианты лечения, имеющиеся в арсенале онколога, не всегда позволяют успешно бороться с плохим прогнозом РПЖ, особенно при наличии метастатического поражения или низкозлокачественной опухоли. Именно у этой категории пациентов мы наблюдаем реализацию многогранного механизма противоопухолевой и иммуномодулирующей активности мелатонина. Мишенями для мелатонина являются многочисленные нарушения гомеостаза, ангиогенеза, межклеточной коммуникации и апоптоз, наблюдаемые у пациентов с плохим прогнозом.
Результаты нашего исследования согласуются с данными о благоприятном противоопухолевом эффекте лечения мелатонином пациентов с распространенными формами рака различной локализации, преимущественно молочной железы, матки, толстой кишки и др. [1, 19–22]. Принимая во внимание оптимистические выводы, полученные в нашей работе на основании большого клинического материала, целесообразно провести проспективные рандомизированные исследования с оценкой выживаемости пациентов с РПЖ различных групп прогноза.
МАТЕРИАЛЫ И МЕТОДЫ
В ретроспективное исследование вошли 955 пациентов с раком простаты, получавших комбинированную гормональную и лучевую терапию в Российском научном центре радиологии и хирургических технологий имени Гранова с 2000 по 2019 год. Пациенты включались в исследование по следующим критериям: наличие полного набора данных об амбулаторном обследовании, лечении и его результатах; и пациенты находились под динамическим наблюдением до даты смерти/крайнего срока (01.06.2020), в зависимости от того, что наступит раньше.
Всем пациентам был поставлен диагноз по трансректальной биопсии простаты с последующей морфологической верификацией и оценкой баллов по шкале Глисона. Сбор пациентов проводился в соответствии с классификацией злокачественных опухолей, рекомендованной Американским объединенным комитетом по изучению рака в 1997 году.
Все пациенты были разделены на две группы в зависимости от приема мелатонина: исследовательская группа (n-396, принимала мелатонин перорально по схеме длительное время); и контрольная группа (n-559, мелатонин не принимала). Мелатонин назначался в конце курса дистанционной лучевой терапии или сразу после постановки диагноза в случае гормональной терапии или химиотерапии. Мелатонин был назначен в форме таблеток в дозе 3 мг за 30 минут до сна ежедневно. Пациенты не получали мелатонин в зимний период (декабрь-февраль). Хорошо известно, что в зимний период уровень мелатонина максимален, а в весенне-летний период уровень мелатонина минимален [13].
Чтобы определить прогностический эффект приема мелатонина на выживаемость пациентов с раком предстательной железы, все пациенты были разделены на прогностические группы. Мы использовали классификацию D’Amico в качестве основы, которая позволила сформировать три прогностические группы: благоприятный прогноз (T1-T2a и ШГ ≤ 6 и ПСА ≤ 10); промежуточный прогноз (T2b и/или ШГ = 7 и/или ПСА > 10–20); и плохой прогноз (≥ T2c или ПСА > 20 или ГШ 8–10). Пациенты с рентгенологически подтвержденным метастатическим РПЖ попали в группу с неблагоприятным прогнозом.
Все пациенты получали комбинированную лучевую гормональную терапию. При терапии учитывалась распространенность опухолевого процесса и она проводилась в соответствии с протоколами лечения, принятыми на период противоопухолевой терапии. Дистанционная лучевая терапия (ДЛТ) проводилась на линейных ускорителях электронов с предельной энергией от 6 до 18 МэВ. Пациентам с благоприятным и промежуточным прогнозом проводилась местная лучевая терапия простаты и семенных пузырьков в разовой местной дозе 3 Гр с общей местной дозой 54–57 Гр (эквивалентная доза - 66–72 Гр). Пациентам с РПЖ с неблагоприятным прогнозом выполнялась ДЛТ поэтапно с суточной дозой облучения. Пациенты с клинически положительными лимфатическими узлами на первом этапе лечения получали регионарную лучевую терапию с однократными дозами от 2 Гр до общей дозы 40–44 Гр. Следующий шаг был основан на локальной радиации. Пациентам с метастатическим поражением костей таза проводилась лучевая терапия, начиная с этапа сегментарного облучения, с однократными дозами 2 Гр до 20 Гр, затем проводилось региональное и местное облучение по схемам, указанным выше. Пациенты с генерализованным метастатическим поражением скелета, сопровождающимся болевым синдромом, получали системную лучевую терапию 89Sr-хлоридом. Андрогенная депривационная терапия (АДТ) проводилась пациентам с различными аналогами гонадотропин-рилизинг-гормона и антиандрогенными препаратами. Некоторым пациентам в качестве метода гормональной терапии была выполнена двусторонняя орхиэктомия. Дополнительная информация о лечении, полученном в каждой группе прогноза, содержится в Таблицах 1–3.
За пациентами, прошедшими терапию, наблюдали динамически с трехмесячными интервалами в течение первого года, затем каждые шесть месяцев. Мы проанализировали общую выживаемость (ОВ), которая рассчитывалась с момента постановки диагноза до даты последнего наблюдения или смерти пациента от любой причины.
Для статистического анализа использовали программный пакет MedCalc 14.12.0 (MedCalc Software, Бельгия). Для характеристики интервальных переменных, имеющих нормальное распределение, использовались среднее (M) и стандартное отклонение (s). Чтобы охарактеризовать порядковые и интервальные переменные, распределение которых не было нормальным, были оценены медиана (Me) и межквартильный размах (IQR).
Т-критерии использовались для оценки различий в группах с нормальным распределением признака. Для оценки различий между двумя группами при отсутствии примерного нормального распределения признака использовался U-критерий Манна–Уитни. Для сравнения более двух независимых выборок применялся анализ отклонений Краскела–Уоллиса. Для оценки взаимосвязи качественных признаков мы использовали метод перекрестной таблицы (критерий хи-квадрат Пирсона, оценка риска и вероятности). Для анализа выживаемости пациентов с РПЖ мы использовали метод умножения оценок Каплана-Мейера, а для его сравнения использовали тест по логранговому критерию. При оценке влияния набора факторов на выживаемость использовалась регрессионная модель пропорциональных рисков Кокса. Уровень значимости p <0,05 считался критерием статистической достоверности полученных выводов.
Вклад авторов
Концепция и дизайн, научное руководство: Геннадий Жаринов, Владимир Анисимов; разработка методологии, привлеченных и управляемых пациентов, анализ и интерпретация данных (например, статистический анализ, биостатистика, вычислительный анализ): Геннадий Жаринов, Олег Богомолов, Ирина Чепурная, Наталья Некласова; написание, рецензирование и/или доработка рукописи: Олег Богомолов, Владимир Анисимов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы не заявляют о конфликте интересов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
- Reiter RJ, Rosales-Corral SA, Tan DX, Acuna-Castroviejo D, Qin L, Yang SF, Xu K. Melatonin, a full service anti-cancer agent: inhibition of initiation, progression and metastasis. Int J Mol Sci. 2017; 18:843. [PubMed].
- Samanta S. Melatonin: an endogenous miraculous indolamine, fights against cancer progression. J Cancer Res Clin Oncol. 2020; 146:1893–1922. PubMed].
- Bartsch C, Bartsch H, Blask DE, Cardinali DP, Hrushesky WJM, Mecke D. The Pineal Gland and Cancer. Neuroimmunoendocrine Mechanisms in Malignancy. Berlin: Springer; 2001.
- Анисимов В.Н. Роль эпифиза в развитии рака груди. Crit Rev Oncol Hematol. 2003; 46:221–234. [PubMed].
- Анисимов В.Н., Попович И.Г., Забежинский М.А., Анисимов С.В., Веснушкин Г.М., Виноградова И.А. Мелатонин как антиоксидант, геропротектор и антиканцероген. Biochim Biophys Acta. 2006; 1757:573–589. [PubMed].
- Menendez-Menendez JM, Martinez-Campa C. Melatonin: an anti-tumor agent in hormone-dependent cancers. Int J Endocrinol. 2018; 2018:3271948. [PubMed].
- Sainz RM, Mayo JC, Tan DX, León J, Manchester L, Reiter RJ. Melatonin reduces prostate cancer cell growth leading to neuroendocrine differentiation via a receptor and PKA independent mechanism. Prostate. 2005; 63:29–43. [PubMed].
- Favero G, Moretti E, Bonomini F, Reiter RJ, Rodella LF, Rezzani R. Promising antineoplastic actions of melatonin. Front Pharmacol. 2018; 9:1086.[PubMed].
- Wu H, Liu J, Yin Y, Zhang D, Xia P, Zhu G. Therapeutic opportunities in colorectal cancer: focus on melatonin antioncogenic action. BioMed Res Int. 2019; 2019:9740568. [PubMed].
- Li Y, Li S, Zhou Y, Meng X, Zhang J, Xu DP, Li HB. Melatonin for the prevention and treatment of cancer. Oncotarget. 2017; 8:39896–39921. [PubMed].
- Bray F, Ferlay J, Soerjomataram I, Siegel R, Torre L, Jemal A. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2018; 68:394–424. [PubMed].
- Ward EM, Germolec D, Kogevinas M, McCormick D, Vermeulen R, Anisimov VN, Aronson KJ, Bhatti P, Cocco P, Costa G, Dorman DC, Fu L, Garde AH, et al, and IARC Monographs Vol 124 group. Carcinogenicity of night shift work. Lancet Oncol. 2019; 20:1058–1059.[PubMed].
- IARC Monographs on the Identification of Carcinogenic Hazards to Humans. Night Shift Work. Volume 124. Lyon: IARC. 2020.
- Papantoniou K, Castaño-Vinyals G, Espinosa A, Aragonés N, Pérez-Gómez B, Burgos J, Gómez-Acebo I, Llorca J, Peiró R, Jimenez-Moleón JJ, Arredondo F, Tardón A, Pollan M, et al. Night shift work, chronotype and prostate cancer risk in the MCC-Spain case-control study. Int J Cancer. 2015; 137:1147–1157. [PubMed].
- Dauchy RT, Hoffman AE, Wren-Dail MA, Hanifin JP, Warfield B, Brainard GC, Xiang S, Yuan L, Hill SM, Belancio VP, Dauchy EM, Smith K, Blask DE. Daytime blue light enhances the nighttime circadian melatonin inhibition of human prostate cancer growth. Comp Med. 2015; 65:473–485. [PubMed].
- De Almeida Chuffa LG, Seiva FRF, Cucielo MS, Silveira HS, Reiter RJ, Lupi LA. Clock genes and the role of melatonin in cancer cells: an overview. Melatonin Res. 2019; 2:133–157.
- Lissoni P, Vigano P, Vaghi M, Frontini L, Giuberti C, Manganini V, Casu M, Brivio F, Niespolo R, Strada G. A phase II study of tamoxifen in hormone-resistant metastatic prostate cancer: possible relation with prolactin secretion. Anticancer Res. 2005; 25:3597–3599. [PubMed].
- Lissoni P. Therapy implications of the role of interleukin-2 in cancer. Expert Rev Clin Immunol. 2017; 13:491–498. [PubMed].
- Анисимов В.Н. Мелатонин и канцерогенез толстой кишки: новая перспектива? EC Gastroenterol Dig Syst. 2018; 5:682–691.
- Wendeu-Foyet MG, Menegaux F. Circadian disruption and prostate cancer risk: an updated review of epidemiological evidences. Cancer Epidemiol Biomarkers Prev. 2017; 26:985–991. [PubMed].
- Seely D, Wu P, Fritz H, Kennedy DA, Tsui T, Seely AJE, Mills E. Melatonin as adjuvant cancer care with and without chemotherapy: a systematic review and meta-analysis of randomized trials. Integr Cancer Ther. 2012; 11:293–303. [PubMed].
- Hill SM, Belancio VP, Dauchy RT, Xiang S, Brimer S, Mao L, Hauch A, Lundberg PW, Summers W, Yuan L, Frasch T, Blask DE. Melatonin: an inhibitor of breast cancer. Endocr Relat Cancer. 2015; 22:R183–204. [PubMed].
Услуги

Для того, чтобы попасть на консультацию/госпитализацию в ООО “Онкоклиника” Вам необходимо обратиться в поликлинику (онкологический диспансер) по месту жительства и получить направление (форма 057/у) с подписью лечащего врача и заверенное печатью лечебного учреждения.

1. ОАК, ОАМ (действительны 5 дней).
2. Биохимия крови: креатинин, мочевина, АЛТ, АСТ, общий белок, билирубин (действительны 14 дней).
3. ЭКГ с расшифровкой (действительно 1 месяц).
Документы
1. Оригиналы паспорта, полиса и СНИЛС.
2. Вся медицинская документация по заболеванию пациента (выписки, МРТ, КТ, ПЭТ-КТ, МСКТ, УЗИ и др. исследования), выписка из амбулаторной карты.
3. Заключение ВК с указанием рекомендованного препарата.
4. Направление по форме 057-у на госпитализацию в ООО «Онкоклиника».

ЗАГРУЗИТЬ ДОКУМЕНТЫ НА САЙТЕ

Администратор связывается с пациентами сразу после проведения консилиума врачей (каждый четверг), на котором рассматривается медицинская документация пациентов и принимается решение о необходимом лечении.
Сеть клиник
- Москва, Россия, 117513, Ленинский проспект, д. 131 (в коллаборации с клиникой "Ваш Доктор" https://vashdr.ru/)
- Московская область, Россия, 142603, город Орехово-Зуево, Стадионная улица, д. 2
- Владимирская область, Россия, 601786, город Кольчугино, ул. 50лет Октября, д. 15
- Владимирская область, Россия, 601144, город Петушки, улица Ленина, д. 15
проходят лечение
в данный момент
- от Ирландии до Сахалина
- от Иордании до Ханты-Мансийского
автономного округа