Исследование пероральной терапии артесунатом при колоректальном раке
Краткий обзор
Предисловие: Артесунат представляет собой противомалярийное средство с широкой противораковой активностью в экспериментах и результатах о случаях применения in vitro и на животных. Артесунат не изучался в строгих клинических испытаниях на противораковые эффекты.
Цели: определить противоопухолевый эффект и переносимость перорального при колоректальном раке (КРР).
Методы: Это было целенаправленное двойное слепое исследование с контрольной группой плацебо и со случайной выборкой пациентов. Пациенты, которым была запланирована лечебная резекция в очаговом районе выявленном биопсией подтверждённая единственным первичным участком в качестве лечения КРР, были выбраны случайным образом (n = 23) с помощью сгенерированного компьютерного кода, который поставляется в непрозрачных конвертах; код же используется для получения перед операцией 14 ежедневных доз перорального артесуната (200 мг; n = 12) или же плацебо(n = 11). Первичным критерием результата была доля клеток опухоли, подвергшихся апоптозу (существенно, если анализ TUNEL показал более 7 %). Вторичные иммуногистохимические результаты данные опухолевые маркеры: VEGF, EGFR, c-MYC, CD31, Ki67 и p53, а также клинические ответы.
Результаты: 20 пациентов (артесунат = 9, плацебо = 11) завершили испытание в соответствии с протоколом. Случайные группы были сопоставимы клинически и по свойствам опухоли. Апоптоз более чем в 7 % клеток наблюдался у 67 % и 55 % в группах артесуната и плацебо соответственно. Используя анализ Байеса, удалось выяснить, что вероятность удачного лечения артесунатом и плацебо составила 0,89 и 0,79 соответственно. Однако, в течение среднего периода наблюдения, длиной 42 месяца, лишь у 1 пациента из группы артесуната и у 6 пациентов из группы плацебо развился рецидив колоректального рака.
Пояснение: артесунат обладает антипролиферативными свойствами при КРР и обычно хорошо переносится.
1. Введение
Колоректальный рак составляет 9 - 10 % от случаев заболевания в год во всём мире у мужчин (746 000 случаев) и у женщин (614 000 случаев). В Великобритании ежедневно диагностируется 110 новых случаев, причём пожилые пациенты особенно подвержены риску смерти, а более 50 % вновь диагностированных случаев имеют сопутствующие заболевания. Резекция – это единственное действительно работающее лечение неметастазирующего КРР, но оно должно сочетаться с неоадъювантной химио- и / или лучевой терапией для ослабления более сложных проявлений. Прогноз при использовании лучших доступных методов лечения не увеличивает выживаемость с ремиссией или общую выживаемость более 60% через 5 лет после постановки диагноза. Для большинства пациентов доступ к передовым методам лечения отсутствует, он слишком дорог для того, чтобы быть широко доступным, или связан со значительной болезненностью, что еще больше снижает их выживаемость. Поэтому существует постоянная и срочная потребность в разработке новых, дешевых, эффективных и безопасных методов лечения КРР. Один из подходов состоит в изучении существующих лекарств, которые уже обладают некоторыми противораковыми свойствами, в экспериментальных условиях и в оценке их безопасности и эффективности в исследованиях in vivo.
Артесунат получают из артемизинина, который экстрагируется из Artemisia annua L., и является широко используемым противомалярийным средством, которое можно вводить пероральным, ректальным и парентеральным путями. Вскоре после выделения артемизинина в рамках китайской правительственной программы впервые были обнаружены противораковые свойства артемизинина. Впоследствии многие исследования артемизининов с использованием моделей in vitro и опытов на животных подтвердили их замечательную способность оказывать широкое противораковое действие. Они уменьшают пролиферацию клеток и тормозят ангиогенез при этом запуская запускают апоптоз. Были только отдельные сообщения о случаях противоракового действия артемизининов у людей. К ним относятся случаи метастатической увеальной меланомы, плоскоклеточной карциномы гортани и макроаденомы гипофиза. Открытое китайское исследование, посвященное лечению пациентов с немелкоклеточным раком легкого, показало, что время до начала активного прогрессирования рака увеличилось по сравнению с контрольной группой, когда артесунат был добавлен к традиционному лечению, но не повлиял на смертность. Первое открытое исследование пациентов, получающих артесунат при лечении запущенного рака шейки матки, показало, что он хорошо переносится и улучшает симптомы. Была проведена II фаза исследования активности артесуната в неоперабельных опухолях собак и эффективности экстрактов A. annua при 5 саркомах у животных. В этом исследовании изучаются эффекты противодействия КРР и переносимость артесуната, используемого в качестве монотерапии, в конкретно обозначенных случаях.
2. Методы
2.1. Этический вопрос.
Исследование было одобрено Этическим Комитетом Уондсворта и было зарегистрировано.
2.2. Общая сводка.
Это было целенаправленное двойное слепое исследование с контрольной группой плацебо со сбалансированной рандомизацией пациентов (1:1), проведенное в Лондонском университете Святого Георгия, Великобритания, и поддержанное доверительной организацией клиники Святого Георгия.
2.3. Выборка участников.
Выбранными участниками исследования были пациенты с колоректальной аденокарциномой единой первичной локализации, которая подтверждена биопсией; в возрасте 21-90 лет; со всеми стадиями, поддающимися хирургическому лечению и не требующими неоадъювантного лечения; с плановой лечебной резекцией; и с письменным информированным согласием.
2.4. Критерии, не позволяющие людям участвовать в исследовании.
К ним относились: противопоказания к применению артесуната из-за гиперчувствительности; беременность; наличие в анамнезе проблем со слухом или равновесием; иммуносупрессия или сопутствующие лекарственные средства, которые, как известно, взаимодействуют с артесунатом (см. ниже); вес <50 кг или >100 кг; тяжелая анемия (гемоглобин <8 г/дл); другое запланированное вмешательство, помимо стандартного ухода; неспособность дать информированное согласие; неспособность или нежелание принимать эффективные контрацептивы у женщин детородного возраста; хроническая болезнь почек в 3 стадии или выше (EGFR <60 мл/мин); билирубин N2 верхней границы нормы без гемолиза или известных хронических заболеваний печени.
2.5. Набор участников.
Набор происходил в Доверительном центре клиники Святого Георгия в Лондоне с 9 марта 2009 года по 15 октября 2012 года.
2.6. Ход работы.
Пациенты получали две недели экспериментального лечения (артесунат или плацебо) непосредственно перед операцией и стандартным лечением. Артесунат (Arinate ® 100 мг) был изготовлен компанией Famar Italia S. p.A, а соответствующие таблетки плацебо были изготовлены компанией MPF в Нидерландах по лицензии на производство в соответствии с ЕС cGMP, сертифицированной компанией Dafra Pharma (Бельгия). Исследуемый препарат был упакован, маркирован и сертифицирован компанией B&C CliniPack (Бельгия) и имел размеры упаковки 30 × 100 мг, а также был получен, сохранен и распределен аптекой St George's Healthcare NHS Trust.
Доза артесуната для исследования составляла 200 мг перорально, ежедневно в течение четырнадцати дней, при этом прием препарата прекращался за 48-72 ч до операции.
Медикаментозное лечение осуществлялось в блистерных упаковках с одной индивидуальной коробкой для каждого пациента, содержащей 14 доз, достаточных на весь период исследования.
Не было никакой задержки в операции, если пациенты входили в это исследование, ни каких-либо других изменений в клиническом ведении, и правило 62 дня (требующее лечения в течение этого периода времени после подтверждения диагноза) было строго соблюдено.
2.7. Результаты.
Первоначальной конечной точкой исследования было наличие или отсутствие значительного апоптоза в эпителиальных клетках опухолевого образца, определяемого как N7% клеток с апоптотическими признаками.
Второстепенные варианты исхода исследования включали в себя: семь иммуногистохимических окрашиваний, нанесенных на парафиновые образцы опухоли и количественно оцененных как в эпителиальных клетках, так и в фибробластах: фактор роста эндотелия сосудов (VEGF), статус c-MYC и EGF-рецепторный статус; плотность микрососудов, определяющая количество кластера дифференцировки 31 (CD31) про-Тейна; пролиферативную активность, оцениваемая с помощью окрашивания Ki67 и экспрессии белка-супрессора опухоли р53. Каждое пятно у каждого пациента обычно оценивалось в 6 микроскопических областях с полуавтоматической системой (в некоторых случаях оценивалось 7 или 8 областей, а в некоторых – особенно для фибробластов-измерения менее 6 или вообще не могли быть оценены).
2.8. Образцы крови.
Были взяты три образца крови: (1) в исходном состоянии, (2) после одной недели приема лекарств (после внесения поправок в протокол для усиления контроля безопасности) и (3) после окончания двухнедельного приема лекарств (непосредственно перед операцией). В каждом образце меры безопасности включали анализ калия, натрия, креатинина, мочевины, альбумина, щелочной фосфатазы, АЛТ, билирубина, гемоглобина, количества тромбоцитов и лейкоцитов. Карциноэмбриональный антиген (КЭА) контролировался там, где он был доступен у пациентов в исходном состоянии и после сравнения результатов.
2.9. Последующие и вторичные результаты.
Это были показатели безопасности и переносимости артесуната (как клинические, так и лабораторные) в соответствии с общепринятыми критериями, оцениваемыми путем сравнения исходных результатов анализа крови и результатов во время или после лечения, а также противораковой эффективности (с маркерами, описанными выше).
2.9.1. Изменения в предполагаемых результатах.
Не было никаких изменений в предполагаемых конечных результатах.
2.10. Размер выборки.
Ориентировочный расчет размера выборки, учитывая инновационный характер этого пилотного исследования, был проведен при первом расчёте до начала исследования, основанного на предположении, что колоректальный рак вряд ли будет вызывать значительный апоптоз, если его не лечить. Ожидалось, что у большинства пациентов в группе плацебо (более 95%) будет менее 7% клеток с апоптотическими свойствами. У большинства пациентов (более 60%) в группе артесуната ожидался значительный апоптоз. Эта большая разница была получена из опубликованных базовых оценок апоптотических индексов. При равных размерах групп размер выборки 2*11 оценивался как имеющий 80%-ную мощность и принимающий ошибку I типа в 5% за превосходство, имея в виду, что в большинстве пилотных исследований цель состоит в том, чтобы продемонстрировать доказательство концепции, а не исключительно проверить гипотезу.
2.11. Принцип случайности раздела групп.
Испытуемые были распределены случайным образом для получения артесуната или плацебо в равных количествах. Разделение проводилось с использованием сгенерированного компьютером кода, а результаты предоставлялись компанией Dafra Pharma в непрозрачных и запечатанных конвертах. После регистрации и выделения следующего номера исследования в серии, участники получили свой специальный пакет от фармацевта. Копии ключей к кодам случайной выборки хранились только у фармацевта клинических испытаний, а этапы распределения и контроля выполнялись в Бельгии. Код не был открыт для исследователей, пациентов, сборщиков данных до тех пор, пока сбор данных не закончился, гистологические результаты не были проанализированы и наборы данных не были заблокированы.
2.12. Механизм сокрытия создания и и распределения последовательностей для случайного выбора.
Исследуемые препараты были предварительно упакованы в блистерные упаковки и последовательно пронумерованы для каждого участника в соответствии с графиком разделения случайным образом. Каждому участнику присваивался порядковый номер после того, как он давал согласие на участие в исследовании и после проверки соответствия требованиям, и они получали упаковку лекарств с соответствующим номером случайного выбора.
2.13. Принцип слепого исследования.
В ходе исследования возникла необходимость отменить принцип эксперимента вслепую 2 участникам по просьбе MHRA после получения уведомления о нежелательных симптомах. Принцип слепого исследования был сохранен для всех инвесторов, и коды были предоставлены офисом спонсора (SGUL) в MHRA.
2.14. Сбор данных и их структура.
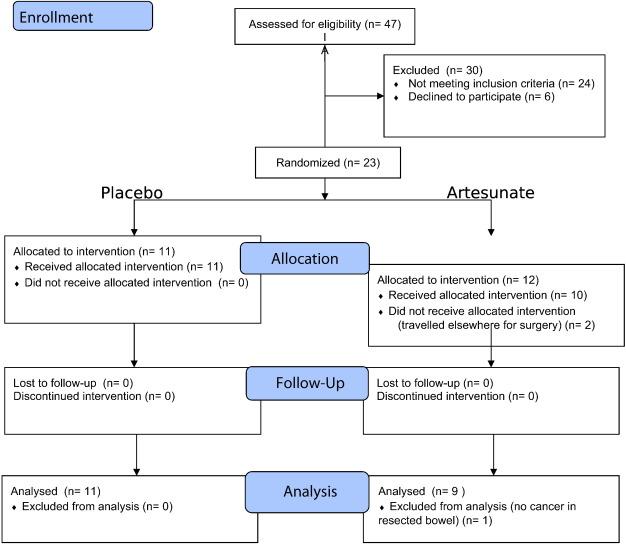
Иммуногистопатологические данные приводили к многократным измерениям на одного человека, поскольку количество слайдов различалось в зависимости от размеров опухолей. Каждое измерение представляет собой оценку окрашивания раковых клеток, обнаруженных на слайде, причем 0 означает отсутствие окрашивания, наблюдаемого на срезе. Таким образом, набор данных наследует иерархическую структуру с пациентами на первом уровне и в рамках отдельных измерений как на уровне два. За исключением трех особей (Рис. 1), нет записей, считающихся недостающими для статистического анализа.
2.15. Исследовательский Статистический Анализ.
Характер всех переменных данных был графически оценен и суммирован соответствующим образом с низким/средним стандартным отклонением для непрерывных данных или пропорциями для двоичных данных. Корреляции были исследованы с коэффициентом Спирмена.
2.16. Результаты иммунохимии и тщательнейший анализ полученных данных.
Модель случайных эффектов (дисперсионных компонентов) была использована для иммунохимических данных, чтобы правильно фиксировать их вариабельность, учитывая присущую им иерархическую структуру.
Пациенты наблюдались с измерениями CEA каждые 6 месяцев и ежегодной компьютерной томографией на предмет рецидива заболевания. Время, прошедшее с момента операции до первого рецидива заболевания, было смоделировано с помощью анализа выживаемости. Пациент CRC06 был включен в анализ выживаемости, и хотя не было получено никаких образцов для иммунохимии, было известно, что пациент выжил. Пациент CRC13 был первоначально рандомизирован на артесунат, но был включен в анализ выживаемости в качестве плацебо, поскольку она не получал никакого препарата (в соответствии с протоколом анализа). Пациент CRC21 был признан отсутствующим, и был проведен анализ чувствительности, включающий его либо в группу артесуната, либо в группу плацебо. Модель пропорциональной опасности ЦОГ(плацебо) (PH) была применена для исследования соотношения рисков рецидива заболевания для артесуната по сравнению с плацебо. И их точечные 95% доверительные интервалы предусмотрены для каждой группы лечения.
2.17. Статистический вывод.
При возникающей необходимости применялся как байесовский анализ на основе моделей так и классические частотные подходы. Частотная статистическая значимость условно ассоциируется с Р-значениями менее 0,05 с неопределенностью параметров, оцениваемых по 95% доверительным интервалам (Ди). Оценки параметров в выводе байесовского анализа суммируются по их итоговым средним значениям и соответствующим 95% достоверных интервалов (CrI). Первоначально не предполагалось никаких предварительных знаний о параметре, количественно определяющем лечебный эффект, т. е. разница между группами выводилась с точки зрения иммунохимических измерений и выводов, которые были сделаны. Если существует предварительная информация, то целесообразно оценить, как изменяются значения параметров на основе этих данных. Ki67 и CD31 были единственными участками с предварительной известной анти-колоректальной информацией. Анализ чувствительности был проведен с помощью Ki67. Использованное статистическое программное обеспечение включало OpenBUGS & STATA.
3.Результаты
3.1. Обзор на участников.
12 пациентов были случайно выбраны для приема артесуната и 11 - для приёма плацебо. 2 пациента не получали артесунат, несмотря на своё присутствие в группе подопытных (один из них выехал на операцию за пределы Великобритании и не мог быть прослежен, а срок годности препарата для соответствующей партии был достигнут, когда другой пациент оказался на месте).Ещё один получатель артесуната не мог быть оценен в первичных результатах точки, поскольку после операции гистологически опухоль не была идентифицирована. Набор участников исследования закончился после того, как было набрано запланированное количество испытуемых.
- Исходные данные
Исходные демографические и клинические характеристики собраны в Таблице 1. Между группами было также произведено сравнение, в том числе по стадиям Дюкса.
Таблица 1
Исходные демографические, клинические и лабораторные характеристики
|
Артесунат N=12 Значение (SD) |
Плацебо n=11 Значение (SD) |
Количествоª (артесунат/плацебо) |
|
|
Демография |
3 |
||
|
Возраст (л) |
69 (11) |
66 (14) |
12/10 |
|
Пол (%, ж) |
0,58 |
0,64 |
|
|
Национальность (% кавказцы) |
0,83 |
0,82 |
|
|
Рост (м) |
1,70 (0,12) |
1,62 (0,08) |
10/9 |
|
Вес (кг) |
74 (16,7) |
75 (66,85) |
11/10 |
|
Биохимия |
|||
|
Натрий (ммоль/л) |
140 (1)ª |
139 (2,28) |
11/11 |
|
Альбумин (г/л) |
38 (5,7) |
36 (5,7) |
11/11 |
|
АЛТ (ЕД/л) |
23 (8) |
24 (10)ª |
11/11 |
|
Билирубин (µмоль/л) |
9 (3) |
8 (3) |
9/11 |
|
Креатинин (µмоль/л) |
73 (23) |
65 (15) |
9/11 |
|
Мочевина (ммоль/л) |
5 (2) |
5 (1) |
9/11 |
|
Гематология |
|||
|
Гемоглобин (г/дл) |
11,5 (2) |
12,2 (2)ª |
9/11 |
|
Количество лейкоцитов (/л) |
5,3 (2,8) |
6,7 (2) |
9/11 |
|
Количество тромбоцитов |
370000 (20000)ª |
31300 (78000) |
8/11 |
|
Стадии Дюкса |
|||
|
А |
2 |
2 |
|
|
В |
5 |
3 |
|
|
С1 |
2 |
6 |
|
|
С2 |
1 |
1 |
ªКоличество добровольцев, учтенных в каждом пункте, отмечено в последней колонке
- Первичный результат
55% реципиентов плацебо и 67% добровольцев, принимавших артесунат, получили первичный результат (пациенты, у который доля апоптических клеток составляла >7%). Во время организации данного исследования предполагалось, что только ≤1/11 пациентов, получающих плацебо, будут иметь >7% опухолевых клеток в стадии апоптоза. Неожиданно высокие исходные данные в группе плацебо препятствовали выявлению эффекта артесуната в первичном результате. Результаты для использования в TUNEL представлены в Таблице 2
Таблица 2.
|
Маркеры |
Значения Артесуната |
95% Crl |
Значения Плацебо |
95% Crl |
Спец. Коэффициент эффекта(P) |
Разница или изменения |
Анализ чувстви тельности |
|
Эпителиальные |
|
||||||
|
c-MYC |
45 |
(27,53) |
43 |
(27,64) |
0.59 |
2.6(-22,26) |
|
|
CD31 |
8 |
(3,12) |
5 |
(2,9) |
0.79 |
2.6(-4,9) |
|
|
EGFR |
32 |
(12,58) |
7 |
(9,45) |
0.66 |
5.4(-24,32) |
|
|
p53 |
25 |
(5,45) |
18 |
(3,35) |
0.72 |
7 (-20,30) |
|
|
Tunel |
18 |
(4,32) |
20 |
(7,32) |
0.4 |
-2(-20,17) |
|
|
VEGF |
38 |
(21,54) |
43 |
(40,75) |
0.45 |
-5(-28,17) |
|
|
Ki67 |
33 |
(13,52) |
49 |
(31,66) |
0.11 |
-16(-42,10) |
N(0, 1000) |
|
Неинформа тивно |
|||||||
|
34 |
(14,53) |
48 |
(31,65) |
0.13 |
-15(-40,10) |
N(0, 100) |
|
|
Малоинформа тивно |
|||||||
|
38 |
(22,54) |
44 |
(29,59) |
0.23 |
-6(-22,10.1) |
N(0, 10) |
|
|
Информативно |
|||||||
|
32 |
(12,51) |
49 |
(32,66) |
0.08 |
-18(-42, 8) |
N(-15, 1000) |
|
|
Неинформативно |
|||||||
|
32 |
(13,51) |
49 |
(32,66) |
0.08 |
-18(-42, 8) |
N(-15, 100) |
|
|
Малоинформативно |
|||||||
|
32 |
(17,49) |
48 |
(33,63) |
0.03 |
-15(-31, 0) |
N(-15, 10) |
|
|
Информативно |
|||||||
|
Фибробластовые |
|||||||
|
c-MYC |
7 |
(-7, 21) |
19 |
(7, 32) |
0.10 |
-12(-30,7) |
|
|
CD31 |
13 |
(-2, 26) |
11 |
(0, 23) |
0.58 |
1(-17,19) |
|
|
EGFR |
0.1 |
(-0.5, 0.7) |
0.4 |
(0, 0.9) |
0.21 |
-0.3(-1,1) |
|
|
Ki67 |
5 |
(-3, 12) |
10 |
(3, 16) |
0.16 |
-5(-15,5) |
|
|
p53 |
0.7 |
(-0.8, 2.1) |
0.9 |
(-0.3,2) |
0.40 |
-0.2(-2.1, 1.2) |
|
|
Tunel |
3 |
(0,5) |
4 |
(1,6) |
0.31 |
0.8(-4,3) |
|
|
VEGF |
0.2 |
(-0.02, 0.5) |
0.2 |
(0.1, 0.3) |
0.52 |
0.02(-0.3, 0.3) |
Предсказанные “грандиозные средства” результатов иммуногистохимии. Результаты представлены в линейной шкале группами лечения с их 95% достоверными интервалами после байесовского анализа, который учитывает вариабельность внутри отдельных измерений, а также между различными индивидуумами в кластере. Вероятность положительного эффекта – это вероятность того, что разница между большими средними в двух группах (артесунат-плацебо) больше 0 (и не является p-значением). *Для Ki67 все соответствующие оценки с информативностью представлены после анализа чувствительности, причем сначала представлены скептические мнения, а затем информативные итоги. Результаты для некоторых эпителиальных случаев были коррелированы друг с другом у реципиентов плацебо (EGFR и c-MYC; r = 0,664; 0,026) и для реципиентов артесуната (EGFR и p53, r = 0,68; p = 0,04 и Tunel и p53, r = 0,87; p = 0,0025).
- Вторичный результат
- Иммуногистохимические анализы
Таблица 2 представляет собой анализ результатов иммуногистохимической диагностики. Случайные эффекты, представленные в линейной шкале, представляют собой апостериорные распределения значений групп, их 95% Crl и их прогнозируемые различия между группами, которые находятся по обе стороны от 0 в большинстве измерений, предполагая, что две группы не имеют существенных различий для большинства изученных маркеров.
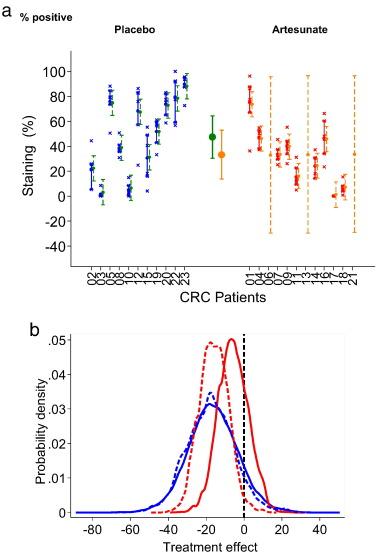
Интересно, что возможность ослабевания окрашивания Ki67 после артесуната составляет 89-92% (Таблица 2: результат 1-0.11, так как Ki67 подавлен) с использованием неинформативного апостериорного распределения в разнице Ki67 между группами и в результате последующих различий -16 (-42, 10) в ходе лечения. Схожий результат подтверждается, если достоверность параметров увеличивается, как показано на Графике 2а. В случае положительного информационного априорного распределения артесуната -15 (N(-15,10)), вероятность эффективности артесуната возрастает до 97% (1-0,03; Таблица 2), изменяя распределение параметров, как показано в Графике 2b.
Для завершения данного анализа мы включили скептическое информативное априорное распределение для этого параметра (N (0, 10)) Несмотря на это, вероятность эффективности артесуната остается на отметке 0,77 с истинным значением в -16 (-22,10; Таблица 2). CD31 также дает высокую вероятность (0,79) эффективности лечения. Показательное иммуноокрашивание представлено на Графике 3.
Представлены индивидуальные результаты окрашивания Ki67 эпителиальных клеток (% положительный), основные показатели в каждой лечебной группе, предсказанные моделью случайных эффектов и индивидуальные прогнозы. Присутствуют межквартиальные интервалы для грубых измерений, а интервалы вероятностью 95% относятся к прогнозируемым индивидуальным и групповым значениям. Этот анализ был сделан со случайными пропущенными значением (MAR) с большой долей неопределенности пропущенных индивидуальных значений, как ожидается и представлено для 3 случайных добровольцев, получающих артесунат, которые не могут быть проанализированы по причинам, данных в результатах. Эти результаты соответствуют неинформативному априорному распределению с учетом различий в двух группах. 2b Анализ чувствительности касательно априорной информации различи между двумя группами с учетом Ki67. Анализ был оправдан опубликованными результатами эксперимента. Вероятность того, что разница между артесунатом и плацебо некативна остается высокой даже в случае скептического априорного распределения без эффекта.
(а) Выявление апоптотических клеток с помощью метода TUNEL, (b) Ki67, (c) p53, (d) EGFR, (e) c-MYC, (f) CD31, (g) VEGF, (h) негативный контроль (без первичных антител). Увеличение х250. Для определения экспрессии белка был использован метод диагностики UltraVision (часть Thermo Fisher Scientific GmbH, Драйайх, Германия), как описано в Дополнительных методах. Имунноокрашенные слайды были просканированы с помощью Panoramic desk (цифровой сканер 3D Histotech Pannoramic, Будапешт, Венгрия) и обработаны (квантификация иммуноокрашенных слайдов) с помощью специального программного обеспечения (NuclearQuant и membraneQuant, 3DHISTECH), положительно окрашенное ядро или мембрана учитывалась в каждой определенной аннотированной области. Оценка параметров включает в себя общее количество выявленных объектов (ядро или мембрана) в каждой аннотированной области, среднее положительное и интенсивность. Окрашенные ядра (Ki67, р53, с-MYC, TUNEL) были посчитаны с использованием программ Nuclear Quant и Membrane-bound, а цитозольное окрашивание — программой MembraneQuant (3D histoQuant). Результаты представлены в Таблице 2.
- Анализ выживаемости
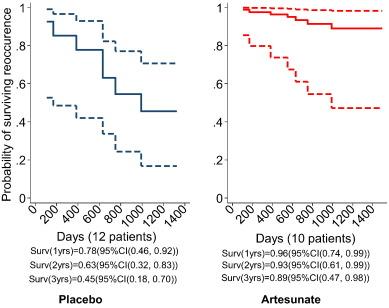
Во время медианного исследования в 42 месяца произошло 6 рецидивов в группе плацебо и 1 рецидив у реципиента артесуната. График 4 иллюстрирует результаты модели пропорциональных рисков Кокса. Коэффициент риска рецидива составляет 0,16 (95% Cl (0,02, 1/3)) в группе артесуната по сравнению с плацебо. Выживаемость после 2 лет в группе артесуната оценивается в 91% (95% Cl (54%б 98%)), в то время как в группе плацебо выживаемость после первого рецидива составляет только 57% (95% Cl (28%, 78%)). Полный анализ чувствительности для пациента CRC21 представлен в Дополнительной Таблице 1. Предполагается, что если этот доброволец находился в группе артемуната без случая рецидива в течение 3 лет, то эффективность препарата относительно выживаемости р будет равна р=0,07 (95% Cl 0,02, 1,21).
Пациент CRC21, предположительно, представляет собой совершенно случайное пропущенное значение (для изучения полного анализа чувствительности, пожалуйста, обратитесь к Дополнительной Таблице 1). В группе плацебо 2 добровольцев умерли в течение года (108, 170 дней), в исследовании осталось 10 (83%), еще двое — в течение следующего года (383, 663 дня), оставив 8 пациентов (66%), в течение третьего года исследования скончалось еще 2 пациента (749 и 990 дней). Таким образом, спустя три года осталось 50% добровольцев. В группе артесуната была зафиксирована 1 смерть спустя 552 дня, спустя 3 года в исследовании осталось 9 добровольцев (90%). Эти оценочные данные подтверждаются данными выше.
- Уровни РЭА
У 6 реципиентов артесуната и 4 реципиентов плацебо были измерены уровни РЭА до и после пробного лечения (и до резекции). В группе артесуната отсутствовали пациенты с повышенным уровнем РЭА, в то время как в плацебо-группе их было 3 (р=0,03, точный тест Фишера).
- Побочные действия
У 6 пациентов (26% популяции ITT) наблюдались побочные явления (2 тяжелых случая, Таблица 3 и Дополнительная Таблица 1). Два случая, возможно, связаны с исследуемым препаратом и детально описаны. В оставшихся 4 случаях возникли 2 случая осложнений (течь анастомозов после хирургического вмешательства), которые, как полагают, не связаны с артесунатом, и один случай железодефицитной анемии (с отсутствием нейтропении) был связан с сопутствующим заболеванием. Также было сообщено об одном случае тошноты. Детальное описание двух случает нейтропении дано ниже и проиллюстрировано в Графике 5.
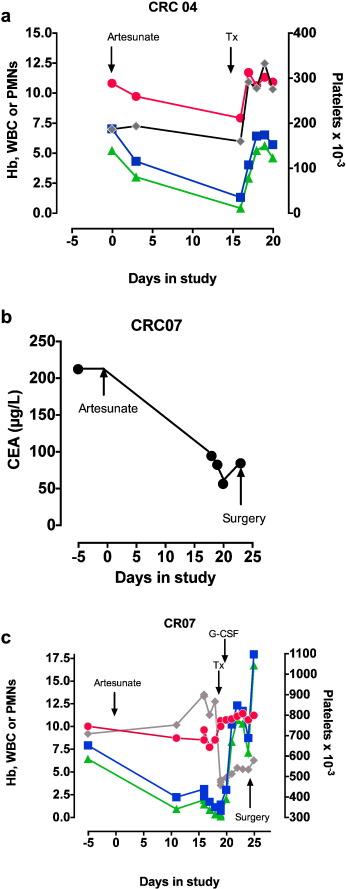
СRC04: У 81-летней женщины весом 51 кг с анемией и изменениями в работе кишечника была обнаружена крупная полиповидная карцинома толстой кишки, которая не была обнаружена во время колоноскопии. Она была случайным образом выбрана для приема артесуната. Промежуточное сканирование не выявило распространения метастаз (CEA=3µг/л). Промежуточный обзор лечения не показал заметных результатов. Она была направлена на операцию, где была подтверждена анемия и нейтропения (График 4а). Ей было сделано переливание крови, таким образом, был зафиксирован побочный эффект III степени по шкале токсичности CTCAE. Нейтропения была вылечена на следующий день.
Пациентка прошла лапароскопическую правостороннюю гемиколэктомию с последующим восстановлением. Ей была предложена послеоперационная химиотерапия при умеренно дифференцированной pT3 аденокарциноме стадии В по Дюксу; она от нее отказалась. Данный случай был записан как нетяжелый побочный эффект, так как последующей госпитализации не последовало.
CRC07: У 79-летней женщины весом 50 кг была обнаружена анемия, ректальное кровотечение и изменения в работе кишечника в течение нескольких предшествующих месяцев.
В ее анамнезе присутствовала карцинома эндометрия, и 11 лет до этого она проходила абдоминальную гистерэктомию и билатеральную сальпингоофорэктомию с последующей лучевой терапией.
Колоноскопия подтвердила аденокарциному с труднопроходимыми структурами у селезеночного изгиба. Промежуточное КТ-сканирование грудного отдела, брюшной полости и области таза исключил метастазы. Пациентка была случайным образом выбрана для получения артесуната (до минимальной отметки в 56 µг/л, График 4b) без последующего вмешательства. У нее наблюдался стойкий тромбоцитоз, далее развилась анемия и лейкопения, которая была обнаружена в день запланированной операции (График 4с). Дооперационный скрининг был проведен за 5 дней до операции, он также зафиксировал анемию и лейкопению. Хирургическое вмешательство было отложено, после соответствующей медицинской консультации и обследования костного мозга анемия была вылечена путем переливания крови, а стойкая нейтропения — G-CSF. Случай зафиксирован как побочное действие III степени по шкале токсичности СТСАЕ.
Биопсия костного мозга показала нормальный эритропоэз с диспластическим гранулопоэзом и задержкой созревания. Некоторое количество миеловидных предшественников было вакуолизировано с нуклеоцитоплазматической асинхронией, но без избытка миелобластов. Мегакариоциты были в большом количестве. Небольшое увеличение плазматических клеток. Результаты связаны с медикаментозной миелосупрессией.
Количество нейтрофилов выросло спустя 2 дня приема G-CSF, который был прекращен. Пациенту была выполнена левосторонняя гемиколэктомия с резекцией en bloc небольшого сегмента тонкой и тонкой кишки и анастомозом тонкой кишки спустя 11 дней приема артесуната без каких-либо послеоперационных осложнений и снижения количества тромбоцитов (График 4с). Аденомакарцинома получила стадию С1 по Дюксу и Т4abN2MO. Опухоль оказалась низкодифференцированной аденокарциномой перстеневидного типа с экстрамулярной сосудистой инвазией. Ей было предложено пройти курс адъювантной химиотерапии, так как риск рецидива составлял ~50%. Она отказалась и предпочла только наблюдение. Спустя 3 года наблюдения было подтверждено полное выздоровление пациентки.
4.Обсуждение
Это первое рандомизированное двойное слепое исследование эффективности перорального лечения колоректального рака артесунатом. Отличительным свойством раковых клеток является избежание апоптоза (Фьядало, Киприаноу, 2012) с более высокими показателями апоптоза, связанными с более агрессивным колоректальным раком (Алькаид и др., 2013). Предварительно определенный первичный критерий (доля пациентов с положительно TUNEL-окрашенными раковыми клетками >7%) после лечения артесунатом был неинформативным, возможно, это связано с неожиданно большим количеством (55%) реципиентов плацебо; был превышен предварительно-определенный порог. Тем не менее, несколько вторичных критериев дали впечатляющие результаты несмотря на небольшой масштаб исследования и изменчивость количественной оценки иммуногистохимических маркеров.
Артесунат обладает высокой вероятностью (0,97, вычислена с помощью информативного априорного распределения в ходе байесовского анализа, График 2b) влияния на Ki67 окрашивание раковых клеток. Это относится и в высокой вероятности воздействия артесуната на Ki67 окрашивание фибробластов (0,84; Таблица 2). Ki67 — это маркер распространения раковых клеток, их повышенная регуляция связана с более неблагоприятным прогнозом при колоректальном раке. Другие биологические маркеры опухолей также оказались под воздействием артесуната, но с меньшей вероятностью (например, вероятность 0,79 повышенной экспрессии CD31). В одном случае (График 4b) было зафиксировано падения уровней РЭА на ~75% после 2 недель лечения артесунатом.
Вероятность отсутствия рецидивов также выше с артесунатом, чем с плацебо (за 3 года 0,89 по сравнению с 0,5; График 3), несмотря на ограниченные оценочные параметры (HR 0,16, р=0,091, Дополнительная Таблица 1) из-за небольшого количества добровольцев и, следовательно, побочных эффектов, включенных в исследование. До данного анализа не было зафиксировано случаев смерти у реципиентов артесуната (хотя у некоторых пациентов были относительно неутешительные прогнозы), но 3 случая летального исхода в плацебо-группе.
У двух пациентов, чей вес достигал нижнего предела для включения в исследование (50 кг, для получения эффективной дозировки в 4 мг/кг артесуната в сутки), развилась лейкопения (График 4). В одном случае заболевание возникло сразу после отмены артесуната, в то время как в другом G-CSF, вероятно, ускорил выздоровление. Исследование костного мозга предполагает токсичное воздействие артесуната. Данные результаты подтверждены недавними наблюдениями в области заболеваний при дозозависимой нейтропении с артесунатом (>4 мг/кг) (Бетел и др., 2010), хотя ранняя диагностика костного мозга не была проведена. Мы ввели промежуточный мониторинг за нейтропенией после наблюдения за малярией, однако не заметили подобных осложнений у других пациентов. Лейкопения, связанная с артесунатом, может быть дозозависимой у раковых пациентов, как в случае с малярией, и хотя позднее был зафиксирован гемолиз после использования артемизинина (Роллинг и др., 2014, 2010), у наших пациентов подобных осложнений не было. В будущих исследованиях будет безопаснее ограничить дозировку артесуната до <4 мг/кг и наблюдать за появлением гематологических осложнений. Недавняя публикация исследования по определению дозы артесуната при раке молочной железы с метастазами предполагает, что 200 мг в сутки может подходить для 3-недельной терапии (Эрикссон и др., 2014).
Наиболее часто у наших пациентов встречалось поражение печени, а затем брюшной полости и яичников. Так как добровольцы имели четкие поперечные и продольные границы во время операции, а различимые метастазы не были выявлены в ходе рандомизации, вероятно, микрометастазы распространились в результате сосудистой инвазии (СИ), вызванной рецидивом. Предыдущий опыт предполагает, что прогноз СИ снижает выживаемость при колоректальном раке (Ганапати и др. 2011; Лианг и др., 2007; Толбот и др., 1980; Бетдж и др., 2012). Пациенты с неясным распространением колоректального рака могут извлечь пользу из систематической нео-адъювантной терапии, и артесунат может быть очень эффективен, так как он не предполагает отсрочки операции. Он также сокращает метастазы в печени модели животного (Ли и др., 2007).
Эти наблюдения предоставляют важную информацию для организации последующих исследований. В ходе оценки нео-адъювантных свойств препарата мы также изучили механизмы действия артесуната на людей с колоректальным раком. Артесунат не возобновляет апоптоз в раковых клетках в нашем исследовании, но значительно снижает экспрессию Ki67. Ki67 — это важный маркер прогноза колоректального рака, в отличие от CD31, чья экспрессия растет. Эти результаты подтверждаются неконтролируемыми наблюдениями, проведенными при раке шейки матки (Янсен и др., 2011), когда также было зафиксировано менее интенсивное окрашивание Ki67, однако менее интенсивное окрашивание CD31 в кровеносных сосудах в этом исследовании противоречит нашим наблюдениям. Детальные лабораторные исследования противораковых механизмов артесуната, например, пролиферации (Эфферт и др., 2007, 2003; Юнг и др., 2004; Конкималла и Эфферт, 2010) (включая ангиогенез) сейчас могут быть интерпретированы в свете исследований in vivo. Необходимо провести более масштабные клинические исследования с артесунатом, направленные на нахождения более эффективной и удобной схемы лечения рака. Они могут предоставить ранее недоступные способы воздействия и взаимоусиливающий эффект текущих схем.
Таблица 3
Побочные действия. Для поиска распределения лечения, пожалуйста, обратитесь к Графику 2а.
|
Номер исследования |
Действие |
На фоне уже существующей болезни |
Связано с исследуемым препаратом |
Серьезность? |
Исследуемое лечение |
Результат |
|
CRC 004 |
Нейтропения и анемия |
Нет |
Возможно |
Нет |
Устранен |
|
|
CRC 007 |
Нейтропения и анемия |
Нет |
Возможно |
Да |
Прекращено |
Устранен |
|
CRC 017 |
Тошнота, но не рвота |
Нет |
Возможно |
Нет |
Продолжено без изменений |
Устранен |
|
CRC 018 |
Течь анастомоза |
Нет |
Не связано |
Да |
|
Устранен |
|
CRC 019 |
Течь анастомоза |
Нет |
Маловероятно |
Да |
Прекращено |
Устранен |
|
CRC 022 |
Анемия |
Да |
Маловероятно |
Нет |
Продолжено без изменений |
Устранен |
График 5. Побочные действия. а. Гемоглобин (заполненные красные круги, г/дл), общее количество лейкоцитов (заполненные синие квадраты, х10-9/л), количество нейтрофилов (зеленые треугольники х10-9/л) и количество тромбоцитов (серые ромбы, х) у пациента CRC 04 показаны с самого начала исследования (День 0). b. Уровень раково-эмбрионального антигена в сыворотке добровольца CRC 07 показан с самого начала исследования (День 0). с. Гематологические результаты пациента CRC 07 показаны с самого начала исследования (День 0) с символами, представлены а. Тх — переливание эритроцитов.
Финансирование и благодарность
Артесунат и плацебо были предоставлены Dafra Pharma (Тюрнхаут, Бельгия). Мы выражаем благодарность доктору Яну Полиниеки за оценку образцов и статистическую поддержку Комитета по мониторингу данных и безопасности, Николаусу Катсоуласу за клиническую поддержку и Дорис Фор за техническую помощь в проведении иммуногистохимии. Это исследование не получало какого-либо прямого финансирования. МЭМС были предоставлены Национальным научно-исследовательским советом Судана. Исследование посвящается памяти Ясмин Кришны.
Авторский вклад
SK и HJ обработали информацию и разработали исследование вместе с PGK, DK и TE; ICS провел статистический анализ, SG, MC, DK и SK занимались отбором добровольцев; HK организовал работу исследования; CF провел клинический гистопатологический анализ; ТE и МЭМС анализировали иммуногистохимию; SK представил первый план-проект, согласно которому все авторы предоставляли информацию для финального отчета. У авторов не возникало никаких конфликтов интересов.
Приложение А. Дополнительные данные
Все дополнительные данные к данной статье доступны онлайн https://www.thelancet.com/journals/ebiom/article/PIIS2352-3964(14)00034-6/fulltext.
Справочный материал
Алькаид Дж., Фунез Р., Руеда А. и др., 2013. Роль и прогностическая ценность апоптоза при колоректальной карциноме. BMC Clin. Pathol. 13 (1), 24.
Анфоссо Л., Эфферт Т., Альбини А., Пфеффер У., 2006. Анализ экспрессии генов, связанных с ангиогенезом, с помощью микрочипа для прогноза ответа раковых клеток на артемизинин. Pharmacogenomics J. 6 (4), 269-278.
Ареин М., Кэмпбел М. Дж., Купер К. Л., Ланкастер Г.А., 2010. Что такое пилотное исследование? Обзор современной практики и редакционной политики. BMC Med. Res. Methodol. 10, 67.
Бендардаф Р., Ристамаки Р., Куяри Х. и др., 2003. Апоптотический индекс и bcl-2 экспрессия как прогностические факторы при колоректальной карциноме. Oncology 64 (4), 435-442.
Бергер Т. Г.,Дикманн Д., Эфферт Т. и др., 2005. Артесунат в лечении увеальной меланомы с метастазами — первые опыты. Oncol. Rep. 14 (6), 1599-1603.
Бетдж Дж., Полхаймер М. Дж., Линдтнер Р. А. и др., 2012. Интрамуральная и экстрамуральная сосудистая инвазия при колоректальном раке: прогностическая значимость и качество патологического исследования. Cancer 118 (3), 628-638.
Бетел Д., Се Й., Лон К. и др., 2010. Дозозависимый риск нейтропении после 7-дневного курса монотерапии артесунатом у добровольцев Камбоджи с острой малярией Plasmodium falciparum. Clin. Infect. Dis. 15, е105-е114.
Бройер И., Эфферт Т., 2014. Лечение железосодержащей саркомы с помощью Artemisia annua. Nat. Prod. Bioprospect. 4. 113-118.
Эфферт Т., Рукер Г., Фалкенберг М. и др., 1996. Обнаружение апоптоза в KG-1a лейкемических клеток при лечении исследуемыми препаратами. Arzneimittelforschung 46 (2), 196-200.
Эфферт Т., Данстэн Х., Зауэебрей А., Миячи Х., Читамбар К., Р., 2001. Противомалярийный артесунат также эффективен против рака. Int. J. Oncol. 18 (4), 767-773.
Эфферт Т., Зауэрбрей А., Олбрич А. и др., 2003. Молекулярные режимы действия артесуната в линиях раковых клеток. Mol. Pharmacol. 64 (2), 382-394.
Эфферт Т., Рамирез Т., Гебхарт И., Халач М. И., 2004. Комбинированное лечение линий клеток мультиформной глиобластомы с помощью противомалярийного артесуната и эпидермальный фактор роста ингибитора рецепторной тирозинкиназы OSI-774. Biochem. Pharmacol. 67 (9), 1689-1700.
Эфферт Т., Джиаизи М., Мерлинг А., Краммер Р. Х., Ли-Уэбер М., 2007. Артесунат вызывает АФК-опосредованный апоптоз в доксорубицин-резистентных лейкемических Т-клетках. PloS One 2 (8), e693.
Эрикссон Т., Влэнк А., фон Хагенс К., Эштон М., Абэло А., 2014. Популяционная фармакокинетика артесуната и дигидроартемизинина во время долгосрочного применения артесуната пациентами с раком молочной железы с метастазами. Eur. J. Clin. Pharmacol. 70, 1453-1463.
Ферлэй Дж.,Соирджоматарам И., Эрвик М. и др., 2012. GLOBOGAN v1.0. Распространенность и коэффициент смертности рака в мире: МАИР База данных No. 11 [Интернет], (доступ 11 июля, 2014).
Фьяндало М.В., Киприаноу Н., 2012. Контроль каспазов: помощник апоптоза раковых клеток. Exp. Oncol. 34 (3), 165-175.
Ганапати С., Кумар Д., Катсоулас Н. и др., 2011. Колоректальный рак в молодом возрасте: тенденции, характеристики и выводы. Int. J. Color. Dis. 26 (7), 927-934.
Гомез М. Ф., Фиаз М.А., Гиапонг Дж. О. и др., 2009. Доврачебный ректальный прием артесуната для избежания смерти и потери трудоспособности при тяжелых формах малярии: плацебо-контролируемое исследование. Lancet 373 (9663), 557-566.
Хин Т. Т., Арнольд К., Вин Х. и др., 1992. Сравнение суппозиторий артемизинина, внутривенного введения артесуната и квинина при лечении церебральной малярии. Trans. R. Soc. Trop. Med. Hyg. 86, 582-583.
Хин Т.Т., Арнольд К., Хунг Н. Г. и др., 1994. Единоразовое лечение артемизинином и мефлохином при острой неосложненной малярии.Trans. R. Soc. Trop. Med. Hyg. 88, 688-691.
Икенага М., Такано Й., Саегуза М. и др., 1996. Апаптоз рака толстой кишки в оценке ДНК in situ методом TUNEL. Pathol. Int. 46 (1), 33-37.
Янсен Ф. Х., Адоуби И., Комои Дж., К. и др., 2011. Первое исследование преорального приема артеминола-R при прогрессирующем раке шейки матки: клинические преимущества, переносимость и онкомаркеры. Anticancer Res. 31 (12), 4417-4422.
Джианг Дж. Б., Ли Г. К., Гуо Кс. В., Конг Й. К., Арнольд К., 1983. Противомалярийное действие мефлохина и артемизинина. Lancet ii, 285-288.
Конкималла В. Б., Эфферт Т., 2010. Подавление сверхэкспрессии рецептора эпидермального фактора роста раковых клеток изохинолиновыми алкалоидами типа апорфины дикентрином. Biochem. Pharmacol. 79 (8), 1092-1099.
Конкималла В. Б., Маккерби Дж. А., Эфферт Т., 2009. Роль нисходящих сигнальных путей рецептора эпидермального фактора роста в воздействии артесуната на раковые клетки. Curr. Canser Drug Targets 9 (1), 72-80.
Кремснер П. Г., Кришна С., 2004. Противораковые комплексы. Lancet 364, 285-294.
Кремснер П. Г., Тейлор Т, Исифоу С. и др., 2012. Упрощенная схема внутривенного введения артесуната при тяжелых формах малярии. J. Infect. Dis. 205 (2), 312-319.
Кришна С., Бастаманте И., Гейнес Р. К., Стеинес Х. М., 2008. Артемизинины: их растущая важность в медицине. Trends Pharmacol. Sci. 29 (10), 520-527.
Ли Л. Н., Жанг Х. Д., Юан С. Й., Тиан З. Й., Уанг Л., Сун З. Кс., 2007. Артесунат ослабляет рост распространения колоректальной карциномы человека и замедляет гиперактивные Wnt/бета-катенин сигнальные пути. Int. J. Cancer 121 (6), 1360-1365.
Лианг П., Накада И., Гонг Дж. У. и др., 2007. Прогностическая важность иммуногистохимического анализа крови и инвазии лимфатических сосудов при колоректальной карциноме: влияние на прогнозы. Ann. Surg. Oncol. 14 (2), 470-477.
Нилон К., Джеинг А, Мюллер-Ромер У. и др., 2002. Внутримышечная биодоступность и клиническая эффективность артесуната у детей Габона с тяжело формой малярии. Antimicrob. Agents Chemother. 46 (12), 3933-3939.
Роллинг Т., Шмидель С., Вихман Д., Виткопф Д., Верчард Г. Д., Крамер Дж. П., 2012. Постлечебный гемолиз при тяжелых формах малярии после внутривенного введения артесуната: описание трех случаев у пациентов с гиперпаразитемией. Malar. J. 1, 169.
Роллинг Т., Агбеньега Т., Иссифоу С. и др., 2014. Отсроченный гемолиз после лечения артесунатом парентеральным путем у африканских детей с тяжелой формой малярии — проспективное двухцентровое исследование. J. Infect. Dis. 209 (12), 1921-1928.
Рутмен Г. Р., Эрих С. А., Мол Дж. А. и др., 2013. Безопасность и эффективность исследований артесуната на собаках с неоперабельными опухолями. Anticancer Res. 33 (5), 1819-1827.
Сингх Н. П., Панвар В. К., 2006. Случай лечения макроаденомы гипофиза артеметером. Integr. Cancer Ther. 5 (4), 391-394.
Сингх Н., Верма К., 2002. Случай лечения плоскоклеточной карциномы гортани артесунатом. Arch. Oncol. 2002, 279-280.
Толбот И. К.,Ричи С., Леитон М. Х., Хьюс А. О., Басси Х. Дж., Морсон Б. К., 1980. Клиническая значимость венозной инвазии при раке прямой кишки. Br. J. Surg. 67 (6), 439-442.
Команда RDC, 2011. Язык и среда статистических вычислений. http://www.R-project.org/ (доступ 11 июля 2014).
Томас А., О'Хара Р., Лиггс У., Штуртц С., 2006. Открывая BUGS. R News 6 (1), 12-17.
UK CR, 2014. Статистика рака кишечника. Http:///www.cancerresearchuk.org/cancer-info/cancerstats/types/bowel/ (доступ 11 июля 2014).
Ямамото Т., Ягараши Н., Като Й., Кобаяши М., Каваками М., 1998. Апоптоз в аденоме и ранняя аденокарцинома толстой кишки. Histol. Histopathol. 13 (3), 743-749.
Юнг Т. М., Баскенс К., Ванг Л. М., Мортенсен Н. Дж., Бодмер У, Ф., 2013. Активация миофибробластов при колоректальном раке с метастазами в лимфатических узлах. Br. J. Cancer 108 (10), 2106-2115.
Жанг Ж. Й., Ю С. К., Миао Л. Й. и др., 2008. комбинация артесуната, винорелбина и цисплатина в лечении прогрессирующего немелкоклеточного рака легких: рандомизированное контролируемое исследование. Zhong Xi Yi Jie He Xue Bao 6 (2), 134-138.