Артемизинин усиливает противоопухолевую иммунную реакцию в раковых клетках молочной железы 4T1 in vitro и in vivo
Yu Caoa,b, Yong-Hui Fengc, Li-Wei Gaod, Xiao-Ying Lib, Quan-Xiu Jinb,e, Yu-Ying Wangb,e, Ying-Ying Xub, Feng Jinb, Shi-Long Lua,f, Min-Jie Weia,*
aЛаборатория точной онкологии, фармацевтический факультет Китайского медицинского университета, Шэньян, Ляонин, Китай
b Отделение хирургической онкологии и хирургии молочной железы, Первая специализированная больница Китайского медицинского университета, Шэньян, Ляонин, Китай c Отделение лабораторной медицины, Первая медицинская больница Китайского медицинского университета, Шэньян, Ляонин, Китай
c Отделение радиационной онкологии, Госпиталь китайско-японской дружбы, Пекин, Китай
d Отделение хирургии молочной железы, Онкологическая больница Ляонин, Шэньян, Ляонин, Китай
eОтделение отоларингологии, Медицинская школа Университета Колорадо, Аврора, Колорадо 80045, США
|
ИНФОРМАЦИЯ О СТАТЬЕ |
АННОТАЦИЯ |
|
|
Ключевые слова: Артемизинин Рак молочной железы Противоопухолевый иммунитет |
Исходные положения: Рак молочной железы – частая причина смерти женщин во всем мире. Недавние исследования показали, что артемизинин (ART) проявляет противоопухолевую активность. Используя модель рака молочной железы у мышей, мы исследовали эффекты ART in vitro и in vivo, чтобы определить его влияние на противоопухолевую иммунную реакцию. Методы: Мы измерили пролиферацию и апоптоз клеток 4T1 in vitro после лечения ART с помощью анализа MTT и FACS. Чтобы изучить эффекты ART in vivo, у мышей с опухолью 4T1 измеряли объемы опухолей и выживаемость. FACS использовали для определения частот Treg, MDSC, CD4 + IFN-γ + T-клеток и цитотоксических T-лимфоцитов (CTL) в опухолях и селезенке мышей. Уровни мРНК факторов транскрипции T-bet и FOXP3 и цитокинов IFN-γ, TNF-α, TGF-β и IL-10 также определялись с помощью ОТ-ПЦР в реальном времени. ELISA использовали для измерения уровней белка TGF-β в супернатантах клеточных культур. Результаты: Добавки ART значительно увеличивали апоптоз клеток 4T1 и снижали уровни TGF-β in vitro. ART также препятствовал росту опухоли у мышей 4T1 TB и увеличивал их выживаемость. Частота MDSC и Treg значительно снизилась у мышей 4T1 TB после лечения ART, в то время как CD4 + IFN-γ + T-клетки и CTL значительно увеличились. ART значительно увеличивал уровни мРНК T-bet, IFN-γ и TNF-α в опухоли и значительно снижал уровни мРНК TGF-β. Выводы: Добавка ART препятствовала росту опухоли 4T1 in vivo, способствуя активации Т-клеток и подавляя иммуносупрессию со стороны Treg и MDSC в опухоли. |
1. Введение
Рак молочной железы остается одной из ведущих причин смерти женщин от рака во всем мире [1]. Несмотря на значительный прогресс в лечении рака молочной железы и увеличении выживаемости пациентов, рак часто рецедивирует [2,3]. Кроме того, побочные эффекты этих методов лечения могут повлечь множество отрицательных последствий для качества жизни пациентов [4,5]. Более глубокое понимание метастазов рака молочной железы и открытие новых лекарств имеют важное значение для разработки новых стратегий лечения, направленных на искоренение рака молочной железы.bookmark34bookmark35bookmark36bookmark37bookmark38
Артемизинин (ART) и его производные уже давно используются в качестве противомалярийных средств благодаря их эффективности и низкой токсичности [6-8]. Однако недавние исследования показали, что производные ART также обладают сильной противоопухолевой активностью. Эти исследования обозначили, что ART подавляет ростbookmark39
многих типов раковых клеток, включая раковые клетки молочной железы, легких, простаты, меланомы, почек, желудка и ЦНС [9-13]. ART также может подавлять рост многих типов устойчивых к лекарствам раковых клеток [9]. Кроме того, производные ART могут также ингибировать рост ксенотрансплантатов опухоли человека, трансплантированных мышам [13].bookmark40bookmark40bookmark41
ART подавляет пролиферацию раковых клеток с помощью нескольких механизмов: 1) ART взаимодействует с двухвалентным железом [14], что приводит к накоплению активных форм кислорода (АФК) [15,16]. Затем АФК ослабляют целостность клетки [17], вызывая остановку клеточного цикла [18], апоптоз [19] и аутофагию [20]; 2) ART подавляет ангиогенез, подавляя секрецию VEGF, VEGFR2 и KDR/flk-1 в опухолях [21,22]; и 3) ART может влиять на сигнальные пути и факторы транскрипции, связанные с ростом опухоли, включая путь Wnt / β-катенин, путь AMPK, передачу сигналов оксида азота, NF-кB, CREBP, MYC/MAX,bookmark42bookmark43bookmark44bookmark45bookmark46bookmark47bookmark48bookmark49bookmark50
mTOR, and AP-1 [23]. Однако иммунные механизмы, на которые влияет ART, не описаны. В настоящем исследовании мы изучили влияние ART на противоопухолевый иммунитет in vitro и in vivo, чтобы определить, можно ли использовать ART для лечения рака молочной железы.
2. Материалы и методы
2.1. Клеточные линии и мыши
Клетки карциномы молочной железы мыши 4T1 (банк клеток Китайской академии наук, Шанхай, Китай) культивировали в среде Игла, модифицированной Дульбекко (DMEM, Gibco, Life Technologies, Inc., США), с добавлением 10% фетальной бычьей сыворотки (FBS, Hyclone , США), 100 мг/мл стрептомицина, 100 Ед/мл пенициллина и 1 мМ L-глутамина. Клетки выращивали при 37 °C, 5% CO2 и 100% влажности. Эксперименты проводились с использованием клеток в фазе экспоненциального роста.
Самок мышей Balb/c в возрасте от шести до восьми недель были приобретены в Центре зоологии Китайской академии наук, Шанхайский филиал. Мышей содержали в стандартных условиях в течение недели до начала эксперимента и обеспечивали беспрепятственный доступ к пище и воде. Все эксперименты на животных проводились в соответствии с положениями Руководства по уходу и использованию лабораторных животных, Китайского закона о защите животных. Протокол эксперимента был одобрен Комитетом по этике экспериментов на животных Китайского национального института здравоохранения (номер разрешения GB 14923-2001).
2.2. Реагенты
Артемизинин (ART, Sigma, Сент-Луис, Миссури, США) суспендировали в диметилсульфоксиде (DMSO, Солон, Огайо, США) с получением основного раствора с концентрацией 10 ммоль/л. Исходный раствор хранили при -20 °C до использования и далее разбавляли в DMEM до его конечной концентрации для использования in vitro. Для экспериментов in vivo ART перед введением разбавляли стерильным PBS до 5 мг/мл. Все антитела для проточной цитометрии были приобретены у BD Pharmingen (Сан-Диего, Калифорния, США), если не указано иное. Набор для твердофазного иммуноферментного анализа (ELISA) TGF-β был получен от R&D Systems (Миннеаполис, Миннесота, США), 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолий бромид (МТТ) был приобретен. от Sigma (Сент-Луис, Миссури, США), а RPMI 1640 с 10% FBS был приобретен у Life Technologies (Бедфорд, Массачусетс, США).
2.3. Создание модели рака молочной железы 4T1
Были собраны субконфлюэнтные клетки 4T1, один раз промыты бессывороточной средой и ресуспендированы в PBS в концентрации 5 × 105 клеток/0,1 мл PBS. Затем 0,1 мл клеточной суспензии имплантировали подкожно в жировую подушку брюшной молочной железы самок мышей BALB/c. После пальпации опухоли (5-7 дней после имплантации) мышей рандомизировали либо в контрольную группу (n = 7; внутрибрюшинное введение 200 мкл стерильного PBS ежедневно в течение 20 дней), либо в группу ART (n = 10; внутрибрюшинная инъекция 100 мг/кг ART, растворенного в 0,2% DMSO, ежедневно в течение 20 дней). Объем опухоли измеряли каждые 2-3 дня по следующей формуле: V = 0,5236 x d12 x d2, где d1 – самый короткий диаметр, а d2 –самый длинный диаметр.
2.4. МТТ-анализ
Клетки 4T1 культивировали при плотности 5 × 103 клеток на лунку в 96-луночных планшетах. Через 24 часа к культурам добавляли ART в следующих концентрациях: 0, 0,01, 0,1, 1, 10 и 100 мкМ в конечном объеме 100 мкл на 24, 48 или 72 часа. Затем в каждую лунку добавляли десять мкл 5 мг/мл МТТ и инкубировали в течение 4 ч при 37 °C. Затем добавляли сто мкл DMSO в течение 10 мин и инкубировали при легком встряхивании. Оптическую плотность (OD) при 570 нм измеряли с помощью спектрофотометра. Все эксперименты проводились пять раз. Скорость пролиферации опухолевых клеток выражается в процентах ингибирования роста клеток по следующей формуле:% клеток = (OD образца, обработанного ART/OD необработанного образца) x 100%.
Таблица 1
Последовательности праймеров для ОТ-ПЦР.
|
Наименование праймера |
Последовательность (5'-3') |
|
β-actin_F |
GATTACTGCTCTGGCTCCTAGC |
|
β-actin_R |
GACTCATCGTACTCCTGCTTGC |
|
IFN-y_f |
GTTACTGCCACGGCACAGTCATTG |
|
IFN-y_R |
ACCATCCTTTTGCCAGTTCCTCCAG |
|
TNF-α_F |
GCAAGCTTCGCTCTTCTGTCTACTGAACTTCGG |
|
TNF-α_R |
GCTCTAGAATGAGATAGCAAATCGGCTGACGG |
|
T-bet_F |
TCAACCAGCACCAGACAGAG |
|
T-bet_R |
AAACATCCTGTAATGGCTTGTG |
|
TGF-β_F |
TGACGTCACTGGAGTTGTACGG |
|
TGF-β_R |
GGTTCATGTCATGGATGGTGC |
|
Il-10_F |
ACCTGCTCCACTGCCTTGCT |
|
Il-10_R |
GGTTGCCAAGCCTTATCGGA |
|
Foxp3_F |
GGCCCTTCTCCAGGACAGA |
|
Foxp3_R |
GCTGATCATGGCTGGGTTGT |
2.5. Анализ по апоптозу
Клетки 4T1 культивировали при наличии либо отсутствии АРТ (100 мкМ) в течение 48 ч в 96-луночных планшетах при концентрации 1 × 10 6 клеток/мл. Для обнаружения апоптоза клетки окрашивали с использованием набора для обнаружения апоптоза Annexin-V I (BD Biosciences) и затем оценивали с помощью проточной цитометрии. Результаты анализировали с помощью программного обеспечения FlowJo v7.6.2 и GraphPad Prism 6.0.1.
2.6. Проточная цитометрия
У мышей с опухолью 4T1 селезенки и опухоли иссекались. Суспензии единичных клеток получали путем гомогенизации образцов селезенки, опухоли измельчали и затем переваривали 500 ед/мл коллагеназы типа IV (Sigma) в течение 1 ч при 37 °C при перемешивании. Полученные суспензии единичных клеток суспендировали в RPMI 1640 с 10% фетальной сывороткой теленка (FCS, Gibco, Англия).
Для окрашивания клеток-супрессоров миелоидного происхождения (MDSC), анти-CD11b FITC (клон M1/70, BD Biosciences) и анти-Gr-1 APC (клон RB6-8C5, BD Biosciences) добавляли к клеткам, суспендированным в PBS с 3% FCS и инкубировали 30 мин. Антитела против CD4 FITC (клон H129.19, BD Biosciences) и анти-CD25 PE (клон PC61, BD Biosciences) использовали для окрашивания клеточной поверхности регуляторных Т-клеток (Tregs). Затем клетки фиксировали и пермеабилизировали для внутриклеточного окрашивания, и добавляли антитело против Foxp3 APC (клон FJK16s, eBioscience). Для анализа CD4 + IFN-y + Т-клеток и цитотоксических Т-лимфоцитов (CTL), экспрессирующих гранзим B, анти-CD4 FITC (клон H129.19, BD Biosciences), анти-CD8a PerCP (клон 53-6.7, BD Biosciences) и APC против IFN-Y (клон XMG1.2, BD Biosciences) добавляли к клеткам и инкубировали в течение 30 мин. Затем клетки фиксировали и пермеабилизировали, и проводили внутриклеточное окрашивание, используя анти-гранизм В PE-антитело (клон NGZB, eBioscience). Все реакции окрашивания проводили в конечном объеме 100 мкл при 4 ° C. Данные были получены с использованием проточного цитометра FACS Calibur (BD Biosciences, Сан-Диего, Калифорния, США) и проанализированы с использованием программного обеспечения FlowJo v7.6.2 (Tree Star Inc., Ashland, OR, США).
2.7. TGF-β ELISA
Коммерческий набор для ELISA (R&D Systems, Миннеаполис, Миннесота, США) использовали для анализа уровней TGF-β в супернатантах клеточных культур. Все этапы выполнялись в соответствии с инструкциями производителя, а значения OD были измерены при 450 нм с использованием считывающего устройства для микропланшетов. Стандартная кривая была построена с использованием известных концентраций рекомбинантных цитокинов, и ее использовали для расчета концентраций TGF-β в образцах.
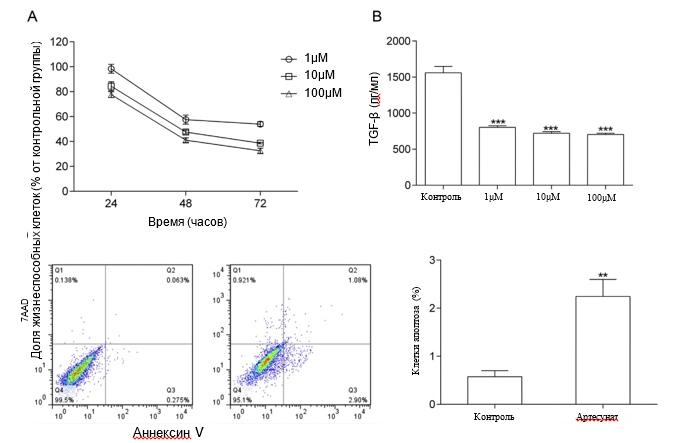
Рис. 1 Лечение АРТ ингибировало пролиферацию клеток 4T1 in vitro. 4 клетки Т1 обрабатывались АРТ в различных концентрациях в течение 24, 48 и 72 часов. Затем определяли пролиферацию клеток с помощью МТТ-анализа. Уровни TGF-β в супернатанте определяли с помощью ELISA после лечения АРТ в течение 48 часов. Апоптоз измеряли с помощью проточной цитометрии. Результаты показаны как среднее ± стандартное отклонение. **P < 0,01 и ***P < 0,001 по сравнению с контрольной группой.
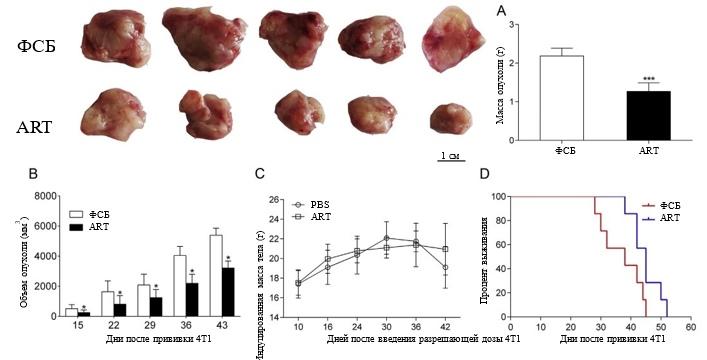
Рис. 2. АРТ подавлял рост опухолей 4T1 и увеличивал выживаемость мышей 4T1 TB. Опухоли удаляли у мышей после лечения АРТ и сравнивали массу тела (А). Кривые объема опухоли (B) и массы тела (C) в конце лечения. Кривые выживаемости (D) мышей 4T1 TB (n = 7). Результаты показаны как среднее ± стандартное отклонение. *P < 0,05 и ***P < 0,001 по сравнению с контрольной группой.
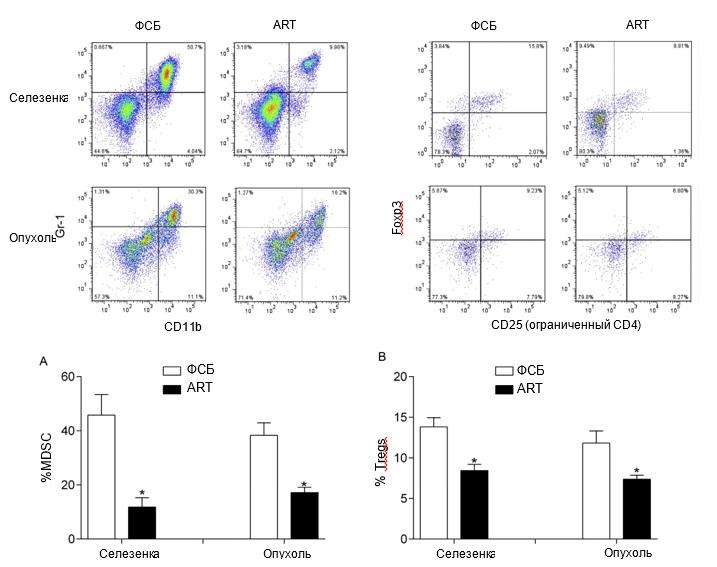
Рис. 3. Лечение АРТ снижало частоту MDSC и Treg в селезенке и опухолях мышей 4T1 TB. Проточно-цитометрический анализ MDSC (CD11b + Gr-1 +) и Treg (CD4 + CD25 + Foxp3 +) как в селезенке, так и в опухоли (A и B). *P < 0.05 по сравнению с контрольной группой.
2.8. Выделение РНК и ОТ-ПЦР в реальном времени
Реагент Trizol (Invitrogen, Carlsbad, CA) использовали для экстракции общей РНК из иссеченных опухолей (~ 100 мг) в соответствии с инструкциями производителя. Затем количественно определяли РНК при 260 нм с использованием спектрофотометра UV-VIS (PYE-UNICAM, США). Чтобы удалить любую примесную геномную ДНК, РНК обрабатывали ДНКазой и синтезировали кДНК с использованием набора реагентов PrimeScript™ RT с набором gDNA Eraser (Takara, Китай). Затем была проведена ПЦР с использованием кДНК в качестве матрицы. В таблице 1 показаны конкретные олигонуклеотидные праймеры, используемые для реакции ПЦР.bookmark14 Количественную ПЦР проводили в системе ABI 7500 Realtime PCR (ABI, США) с использованием набора реагентов SYBR® Premix Ex Taq™ (Takara) в соответствии с инструкциями производителей. Амплификация β-актина служила внутренним контролем. Экспрессию генов количественно оценивали с использованием метода 2-δδCT.
2.9. Статистический анализ
Результаты представлены как среднее значение ± стандартное отклонение трех экспериментов. Для проверки статистической значимости использовали односторонний дисперсионный анализ и двусторонний t-критерий Стьюдента. Метод Каплана-Мейера использовался для расчета анализа выживаемости. P < 0,05 считали статистически значимым.
3. Результаты
3.1. ART подавляет пролиферацию клеток 4T1
Было продемонстрировано, что ART значительно подавляет пролиферацию некоторых клеток рака молочной железы, но этот эффект не проявился на клетках 4T1. Поэтому мы провели анализ МТТ для изучения пролиферации клеток 4T1 после лечения ART. Высокие дозы (10 мкМ и 100 мкМ) ART значительно подавляли пролиферацию клеток 4T1, начиная с 24 часов после обработки. Более низкие дозы (0,01 мкМ, 0,1 мкМ и 1 мкМ) ART также подавляли пролиферацию, но не ранее, чем через 48 часов после лечения. Кроме того, лечение ART также индуцировало апоптоз клеток 4T1, так как 100 мкМ ART значительно увеличивали скорость апоптоза опухолевых клеток (P < 0,01). Кроме того, уровни трансформирующего фактора роста β (TGF-β) в супернатанте значительно снизились после лечения ART (концентрации в диапазоне от 1 до 100 мкМ, P < 0,001) (рис. 1).bookmark18
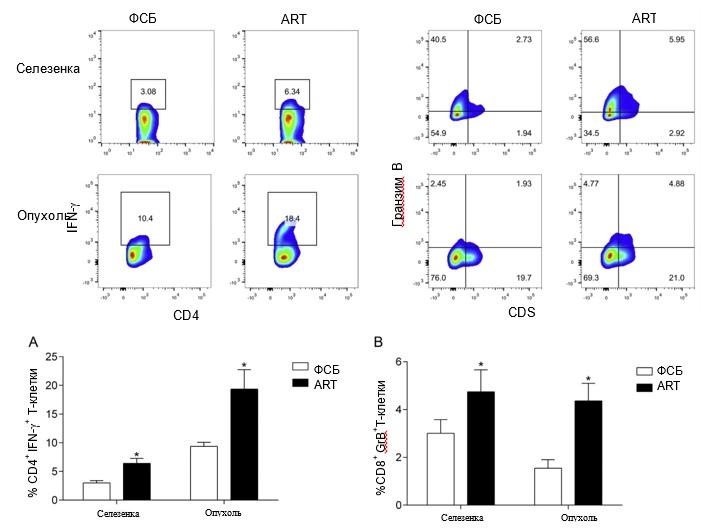
Рис. 4. ART способствовал опосредованным Т-клетками противоопухолевым иммунным реакциям. Проточно-цитометрический анализ CD4 + IFN-y + Т-клеток и CTL в селезенке и опухоли от мышей 4T1, получавших ART или PBS (контроль). *P < 0,05 по сравнению с контрольной группой.
3.2. АРТ подавляет рост клеток рака молочной железы 4T1 и продлевает выживаемость мышей 4T1 TB
Для определения, может ли ART подавлять развитие опухоли и увеличивать выживаемость мышей 4T1 TB, мышам давали ART ежедневно в течение 20 дней. Мы обнаружили, что объем опухоли в группе ART уменьшился по сравнению с объемом опухоли в контрольной группе (рис. 2B). Точно так же вес и размер опухолей значительно уменьшились в группе ART (P < 0,001) по сравнению с контрольной группой (рис. 2A). Никаких различий в массе тела между двумя группами не наблюдалось (рис. 2С). Все контрольные мыши умерли через 28-45 дней после инокуляции 4 клеток Т1. Однако добавление АРТ значительно увеличивало выживаемость мышей 4T1, при этом случаев смерти не наблюдалось до 38 дней после инокуляции (P < 0,05; рис. 2D).bookmark19bookmark19bookmark19bookmark19
3.3. АРТ подавляет распространение Treg и MDSC в селезенке и опухоли
CD11b + Gr-1 + MDSC подавляют иммунные реакции в микроокружении опухоли и напрямую стимулируют онкогенез, тем самым способствуя развитию опухоли [24]. Чтобы оценить, может ли лечение АРТ подавлять распространение MDSC, частота MDSC в селезенке и опухолях мышей 4T1 TB была проанализирована с помощью проточной цитометрии. Мы обнаружили, что частота MDSC была значительно ниже как в образцах селезенки (P < 0,05), так и в образцах опухолей (P < 0,05) мышей 4T1 TB, получавших АРТ, по сравнению с подконтрольными мышами (рис. 3A).bookmark52bookmark20
Предыдущие исследования показали, что индуцированные опухолью регуляторные B-клетки (tBregs) могут стимулировать дифференцировку FoxP3 + Treg из покоящихся нерегулирующих CD4 + T-клеток, что подавляет противоопухолевый иммунитет носителя и способствует метастазированию [25]. Поэтому мы также измерили частоту Treg в селезенке и опухолях мышей 4T1 TB, получавших и не получавших лечения. Лечение ART значительно снизило процент Treg у мышей с ТБ (P <0,05, рис. 3В), что указывает на то, что ART может ингибировать иммуносупрессию в микроокружении опухоли.bookmark53bookmark20
3.4. ART способствует активации Т-лимфоцитов
Т-клетки играют важную роль в противоопухолевом иммунном ответе и, следовательно, в предотвращении роста опухоли. Чтобы определить, может ли ART вызывать активацию Т-клеток, мы количественно определили процентное содержание CD4 + IFN-γ + Т-клеток и цитотоксических Т-лимфоцитов (CTL), экспрессирующих гранзим B, в селезенках и опухолях мышей 4T1. Лечение ART привело к значительному увеличению процента CD4 + IFN-γ + Т-клеток как в образцах селезенки, так и в образцах опухоли (рис. 4A, P <0,05). Лечение ART также значительно увеличивало экспансию гранзим В + CTL (рис. 4B, P <0,05). Эти результаты показывают, что ART может способствовать активации Т-клеток.bookmark25bookmark25
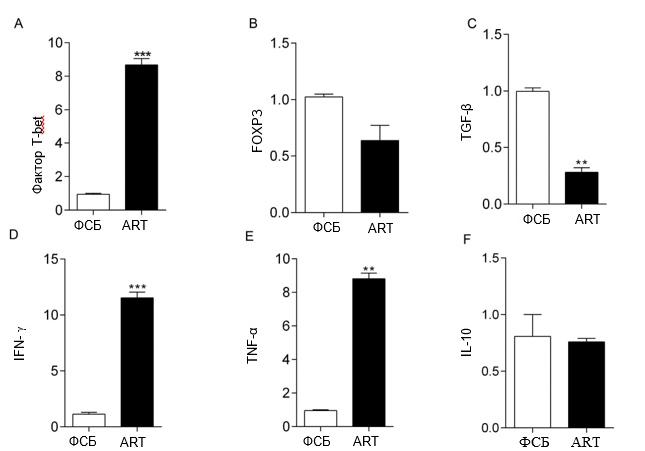
Рис. 5. Фактор транскрипции и экспрессия цитокинов, индуцированная ART. Уровни мРНК T-bet, FOXP3, IFN-γ, TNF-α, TGF-β и IL-10 в опухолевой ткани измеряли с помощью qRT-PCR. ** P < 0,01 по сравнению с контрольной группой.
3.5. Лечение ART увеличивает экспрессию иммунных медиаторов в микросреде опухоли
Различные иммунные медиаторы в микросреде опухоли, включая цитокины и факторы транскрипции, играют решающую роль в подавлении прогрессирования рака молочной железы. Мы использовали qRT-PCR для измерения относительных уровней экспрессии мРНК факторов транскрипции T-bet и FOXP3, а также цитокинов IFN-y, TNF-α, TGF-β и IL-10 в опухолевых тканях мышей 4T1. Как показано на рис. 5, экспрессия T-bet и связанного с ним провоспалительного цитокина IFN-y, а также TNF-α увеличивалась после лечения ART (P <0,01). Уровни мРНК TGF-β в опухоли значительно снизились после лечения ART (P <0,01), в то время как уровни IL-10 существенно не изменились. Экспрессия Foxp3, фактора транскрипции, активного в Tregs, также существенно не изменилась.bookmark29
4. Обсуждение
Несмотря на успехи в лечении, рак молочной железы, как ведущую причину смерти женщин, по-прежнему трудно контролировать. Хотя для лечения рака молочной железы использовалось множество различных подходов, некоторые из этих методов лечения обладают значительной токсичностью и могут привести к лекарственной устойчивости. Таким образом, существует острая потребность в новых лекарственных препаратах, нацеленных на раковые клетки без побочных эффектов. Помимо антималярийной активности, ART показал сильную противоопухолевую активность в предыдущих исследованиях, особенно при агрессивных метастатических раковых опухолях [26]. В настоящем исследовании мы продемонстрировали, что снижение роста рака молочной железы, связанное с ART, зависит от подавления MDSC и Treg.bookmark54
TGF-β участвует в функционировании и развитии эпителия молочных желез и способствует метастазированию рака, индуцируя эпителиальный переход в мезенхимальный (EMT) раковых клеток [27,28]. Все больше данных свидетельствует о том, что TGF-β изначально подавляет рост опухоли, но что конститутивная активация TGF-β способствует росту опухоли [29,30]. Предыдущие клинические исследования показали, что чрезмерные уровни TGF-β у пациентов с раком молочной железы связаны с метастазами в кости и регионарные лимфатические узлы [31]. В этом исследовании мы продемонстрировали, что уровни белка TGF-β в супернатанте культуры клеток 4T1 и уровни мРНК в опухоли снижаются после лечения ART.bookmark55bookmark56bookmark57bookmark58bookmark59
MDSC являются ключевым типом иммуносупрессивных клеток и могут подавлять опосредованный Т-клетками противоопухолевый иммунитет при раке молочной железы [32]. Супрессивные способности MDSC тесно связаны с их непрерывной экспрессией ARG-1, который метаболизирует l-аргинин [33]. Кроме того, MDSC участвуют в ангиогенезе, инвазии и метастазировании раковых клеток [34]. Другой механизм, подавляющий развитие опухоли, - это сверхэкспрессия PD1 или CTLA-4 с помощью Treg [35–37]. CD4 + CD25 + Foxp3 + Tregs представляют собой тип иммунных клеток, играющих важную роль в контроле баланса между про- и противовоспалительными иммунными реакциями [38,39].bookmark60bookmark61bookmark62bookmark63bookmark64bookmark65 Foxp3, фактор транскрипции, экспрессируемый в Tregs, необходим для развития и поддержания Tregs [40]. IL-10 и TGF-β, а также устойчивая экспрессия ингибирующего CTLA-4 являются ключевыми медиаторами Treg-индуцированной иммуносупрессии [41,42]. Подавление противоопухолевых реакций с помощью Treg было впервые продемонстрировано у мышей, получавших моноклональные антитела против CD25 (клон PC61), которые вызвали регресс опухоли [43]. В модели опухоли 4T1 истощение Treg приводит к накоплению CTL в опухоли [44,45]. В настоящем исследовании добавление ART значительно снижало частоту MDSC и Treg как в опухолях, так и в селезенке, указывая на то, что лечение ART может остановить иммуносупрессию, вызванную MDSC и Treg, у мышей, несущих 4T1.bookmark66bookmark67bookmark68bookmark69bookmark70bookmark71
Противоопухолевый иммунитет, опосредованный CTL (CD8 + цитотоксические Т-клетки) и CD4 + T-хелперами 1 (Th1), подавляет рост раковых клеток [46,47]. Клетки CD4 + Th1 выделяют цитокины, включая IFN-y и TNF-α. IFN-y стимулирует производство активных форм кислорода (ROS) и реактивных bookmark72bookmark73
азотных частиц (RNS) из макрофагов, что приводит к разрушению раковых клеток [48]. Клетки Th1 проявляют свой противоопухолевый эффект посредством двух основных механизмов: 1) они могут напрямую убивать опухолевые клетки, задействуя связанные с TNF пути лиганда, индуцирующего апоптоз (TRAIL) или лиганда Fas / Fas (FasL) [49] либо 2) они могут помочь генерировать и усиливать реакции CTL [50]. Мы обнаружили, что лечение ART значительно увеличивало частоту встречаемости клеток CTL и Th1, а также уровни экспрессии IFN-y и TNF-α в опухоли. В заключение, ART подавляет рост рака молочной железы in vivo, способствуя активации Т-клеток, а также подавляя Treg и MDSC в микросреде опухоли.bookmark74bookmark75bookmark76
Выражения признательности
Данные исследования были поддержаны грантами Фонда постдокторантуры Китая (2017M621178, Y. Cao) и Национального фонда естественных наук Китая (81773083, Y.Y. Xu, 81773163, F. Jin). Мы благодарим сотрудников Колледжа зоотехники и технологий за их помощь.
Библиографический список
[1] A. Jemal, F. Bray, M.M. Center, J. Ferlay, E. Ward, D. Forman, Global cancer statistics, CA Cancer J. Clin. 61 (2) (2011) 69-90.
[2] S.M. Stemmer, M. Steiner, S. Rizel, L. Soussan-Gutman, N. Ben-Baruch, A. Bareket- Samish, D.B. Geffen, B. Nisenbaum, K. Isaacs, G. Fried, et al., Clinical outcomes in patients with node-negative breast cancer treated based on the recurrence score results: evidence from a large prospectively designed registry, NPJ Breast Cancer 3 (2017) 33.
[3] H. Pan, R. Gray, J. Braybrooke, C. Davies, C. Taylor, P. McGale, R. Peto, K.I. Pritchard, J. Bergh, M. Dowsett, et al., 20-Year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years, N. Engl. J. Med. 377 (19) (2017) 1836-1846.
[4] C.M. Perou, T. Sorlie, M.B. Eisen, M. van de Rijn, S.S. Jeff rey, C.A. Rees, J.R. Pollack, D.T. Ross, H. Johnsen, L.A. Akslen, et al., Molecular portraits of human breast tumours, Nature 406 (6797) (2000) 747-752.
[5] J.J. Tao, K. Visvanathan, A.C. Wolff, Long term side effects of adjuvant chemotherapy in patients with early breast cancer, Breast 24 (Suppl. 2) (2015) S149-S153.
[6] R.J. Maude, K. Plewes, M.A. Faiz, J. Hanson, P. Charunwatthana, S.J. Lee, J. Tarning, E.B. Yunus, M.G. Hoque, M.U. Hasan, et al., Does artesunate prolong the electrocardiograph QT interval in patients with severe malaria? Am. J. Trop. Med. Hyg. 80 (1) (2009) 126-132
[7] W.R. Taylor, N.J. White, Antimalarial drug toxicity: a review, Drug Saf. 27 (1) (2004) 25-61.
[8] T. Efferth, From ancient herb to modern drug: Artemisia annua and artemisinin for cancer therapy, Semin. Cancer Biol. 46 (2017) 65 -83.
[9] T. Efferth, H. Dunstan, A. Sauerbrey, H. Miyachi, C.R. Chitambar, The anti-malarial artesunate is also active against cancer, Int. J. Oncol. 18 (4) (2001) 767-773.
[10] T. Eff erth, M. Davey, A. Olbrich, G. Rucker, E. Gebhart, R. Davey, Activity of drugs from traditional Chinese medicine toward sensitive and MDR1- or MRP1-over- expressing multidrug-resistant human CCRF-CEM leukemia cells, Blood Cells Mol. Dis. 28 (2) (2002) 160-168.
[11] Y. Gong, B.M. Gallis, D.R. Goodlett, Y. Yang, H. Lu, E. Lacoste, H. Lai, T. Sasaki, Effects of transferrin conjugates of artemisinin and artemisinin dimer on breast cancer cell lines, Anticancer Res. 33 (1) (2013) 123-132.
[12] H.T. Zhang, Y.L. Wang, J. Zhang, Q.X. Zhang, Artemisinin inhibits gastric cancer cell proliferation through upregulation of p53, Tumour Biol. 35 (2) (2014) 1403-1409.
[13] Y.J. Zhang, X. Zhan, L. Wang, R.J. Ho, T. Sasaki, pH-responsive artemisinin dimer in lipid nanoparticles are effective against human breast cancer in a xenograft model, J. Pharm. Sci. 104 (5) (2015) 1815-1824.
[14] N.P. Singh, H. Lai, Selective toxicity of dihydroartemisinin and holotransferrin toward human breast cancer cells, Life Sci. 70 (1) (2001) 49-56.
[15] R. Kong, G. Jia, Z.X. Cheng, Y.W. Wang, M. Mu, S.J. Wang, S.H. Pan, Y. Gao, H.C. Jiang, D.L. Dong, et al., Dihydroartemisinin enhances Apo2L/TRAIL-mediated apoptosis in pancreatic cancer cells via ROS-mediated up-regulation of death receptor 5, PLoS One 7 (5) (2012) e37222.
[16] H. Zhu, S.D. Liao, J.J. Shi, L.L. Chang, Y.G. Tong, J. Cao, Y.Y. Fu, X.P. Chen, M.D. Ying, B. Yang, et al., DJ-1 mediates the resistance of cancer cells to dihydroartemisinin through reactive oxygen species removal, Free Radic. Biol. Med. 71 (2014) 121-132.
[17] P.C. Li, E. Lam, W.P. Roos, M.Z. Zdzienicka, B. Kaina, T. Efferth, Artesunate derived from traditional Chinese medicine induces DNA damage and repair, Cancer Res. 68 (11) (2008) 4347-4351.
[18] J. Hou, D. Wang, R. Zhang, H. Wang, Experimental therapy of hepatoma with artemisinin and its derivatives: in vitro and in vivo activity, chemosensitization, and mechanisms of action, Clin. Cancer Res. 14 (17) (2008) 5519-5530.
[19] H. Mao, H. Gu, X. Qu, J. Sun, B. Song, W. Gao, J. Liu, Q. Shao, Involvement of the mitochondrial pathway and Bim/Bcl-2 balance in dihydroartemisinin-induced apoptosis in human breast cancer in vitro, Int. J. Mol. Med. 31 (1) (2013) 213-218.
[20] A. Hamacher-Brady, H.A. Stein, S. Turschner, I. Toegel, R. Mora, N. Jennewein, T. Efferth, R. Eils, N.R. Brady, Artesunate activates mitochondrial apoptosis in breast cancer cells via iron-catalyzed lysosomal reactive oxygen species production, J. Biol. Chem. 286 (8) (2011) 6587-6601.
[21] R. Dell'Eva, U. Pfeffer, R. Vene, L. Anfosso, A. Forlani, A. Albini, T. E fferth, Inhibition of angiogenesis in vivo and growth of Kaposi's sarcoma xenograft tumors by the anti-malarial artesunate, Biochem. Pharmacol. 68 (12) (2004) 2359-2366.
[22] H.H. Chen, H.J. Zhou, W.Q. Wang, G.D. Wu, Antimalarial dihydroartemisinin also inhibits angiogenesis, Cancer Chemother. Pharmacol. 53 (5) (2004) 423-432.
[23] E. Thomas, Artemisinin -second career as anticancer drug? World J. Tradit. Chin. Med. 1 (4) (2016) 2-25.
[24] S. Danilin, A.R. Merkel, J.R. Johnson, R.W. Johnson, J.R. Edwards, J.A. Sterling, Myeloid-derived suppressor cells expand during breast cancer progression and promote tumor-induced bone destruction, Oncoimmunology 1 (9) (2012) 1484-1494.
[25] P.B. Olkhanud, B. Damdinsuren, M. Bodogai, R.E. Gress, R. Sen, K. Wejksza, E. Malchinkhuu, R.P. Wersto, A. Biragyn, Tumor-evoked regulatory B cells promote breast cancer metastasis by converting resting CD4(+) T cells to T-regulatory cells, Cancer Res. 71 (10) (2011) 3505-3515.
[26] Q. Xu, Z.X. Li, H.Q. Peng, Z.W. Sun, R.L. Cheng, Z.M. Ye, W.X. Li, Artesunate inhibits growth and induces apoptosis in human osteosarcoma HOS cell line in vitro and in vivo, J Zhejiang Univ Sci B 12 (4) (2011) 247-255.
[27] H. Moses, M.H. Barcellos-Hoff, TGF-beta biology in mammary development and breast cancer, Cold Spring Harb. Perspect. Biol. 3 (1) (2011) a003277.
[28] Z. Zhong, K.D. Carroll, D. Policarpio, C. Osborn, M. Gregory, R. Bassi, X. Jimenez, M. Prewett, G. Liebisch, K. Persaud, et al., Anti-transforming growth factor beta receptor II antibody has therapeutic efficacy against primary tumor growth and metastasis through multieffects on cancer, stroma, and immune cells, Clin. Cancer Res. 16 (4) (2010) 1191-1205.
[29] P.M. Siegel, W. Shu, R.D. Cardiff, W.J. Muller, J. Massague, Transforming growth factor beta signaling impairs neu-induced mammary tumorigenesis while promoting pulmonary metastasis, Proc. Natl. Acad. Sci. U. S. A. 100 (14) (2003) 8430-8435.
[30] B. Tang, M. Vu, T. Booker, S.J. Santner, F.R. Miller, M.R. Anver, L.M. Wakefield, TGF-beta switches from tumor suppressor to prometastatic factor in a model of breast cancer progression, J. Clin. Invest. 112 (7) (2003) 1116- 1124.
[31] A. Ghellal, C. Li, M. Hayes, G. Byrne, N. Bundred, S. Kumar, Prognostic signi ficance of TGF beta 1 and TGF beta 3 in human breast carcinoma, Anticancer Res. 20 (6B) (2000) 4413-4418.
[32] J. Yu, W. Du, F. Yan, Y. Wang, H. Li, S. Cao, W. Yu, C. Shen, J. Liu, X. Ren, Myeloid- derived suppressor cells suppress antitumor immune responses through IDO expression and correlate with lymph node metastasis in patients with breast cancer, J. Immunol. 190 (7) (2013) 3783-3797.
[33] I. Marigo, L. Dolcetti, P. Serafini, P. Zanovello, V. Bronte, Tumor-induced tolerance and immune suppression by myeloid derived suppressor cells, Immunol. Rev. 222 (2008) 162-179.
[34] S.J. Priceman, J.L. Sung, Z. Shaposhnik, J.B. Burton, A.X. Torres-Collado, D.L. Moughon, M. Johnson, A.J. Lusis, D.A. Cohen, M.L. Iruela-Arispe, et al., Targeting distinct tumor-infiltrating myeloid cells by inhibiting CSF-1 receptor: combating tumor evasion of antiangiogenic therapy, Blood 115 (7) (2010) 1461-1471.
[35] N. Zhang, B. Schroppel, G. Lal, C. Jakubzick, X. Mao, D. Chen, N. Yin, R. Jessberger, J. C. Ochando, Y. Ding, et al., Regulatory T cells sequentially migrate from inflamed tissues to draining lymph nodes to suppress the alloimmune response, Immunity 30 (3) (2009) 458-469.
[36] M. Ahmadzadeh, L.A. Johnson, B. Heemskerk, J.R. Wunderlich, M.E. Dudley, D.E. White, S.A. Rosenberg, Tumor antigen-specific CD8 T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired, Blood 114 (8) (2009) 1537-1544.
[37] H.C. Probst, K. McCoy, T. Okazaki, T. Honjo, M. van den Broek, Resting dendritic cells induce peripheral CD8+ T cell tolerance through PD-1 and CTLA-4, Nat. Immunol. 6 (3) (2005) 280-286.
[38] M.A. Gavin, J.P. Rasmussen, J.D. Fontenot, V. Vasta, V.C. Manganiello, J.A. Beavo, A.Y. Rudensky, Foxp3-dependent programme of regulatory T-cell differentiation, Nature 445 (7129) (2007) 771-775.
[39] S. Sakaguchi, F. Powrie, Emerging challenges in regulatory T cell function and biology, Science 317 (5838) (2007) 627-629.
[40] S. Hori, T. Nomura, S. Sakaguchi, Control of regulatory T cell development by the transcription factor Foxp3, Science 299 (5609) (2003) 1057-1061.
[41] B. Chaudhary, E. Elkord, T. Regulatory, Cells in the tumor microenvironment and cancer progression: role and therapeutic targeting, Vaccines (Basel) 4 (3) (2016).
[42] Y. Takeuchi, H. Nishikawa, Roles of regulatory T cells in cancer immunity, Int. Immunol. 28 (8) (2016) 401-409.
[43] S. Onizuka, I. Tawara, J. Shimizu, S. Sakaguchi, T. Fujita, E. Nakayama, Tumor rejection by in vivo administration of anti-CD25 (interleukin-2 receptor alpha) monoclonal antibody, Cancer Res. 59 (13) (1999) 3128-3133.
[44] A. Tanaka, S. Sakaguchi, Regulatory T cells in cancer immunotherapy, Cell Res. 27 (1) (2017) 109-118.
[45] H. Nishikawa, S. Sakaguchi, Regulatory T cells in cancer immunotherapy, Curr. Opin. Immunol. 27 (2014) 1- 7.
[46] S.I. Grivennikov, F.R. Greten, M. Karin, Immunity, inflammation, and cancer, Cell 140 (6) (2010) 883-899.
[47] G. Verdeil, S.A. Fuertes Marraco, T. Murray, D.E. Speiser, From T cell “exhaustion ” to anti-cancer immunity, Biochim. Biophys. Acta 1865 (1) (2016) 49-57.
[48] T. Wieder, H. Braumuller, M. Kneilling, B. Pichler, M. Rocken, T cell-mediated help against tumors, Cell Cycle 7 (19) (2008) 2974-2977.
[49] H. Braumuller, T. Wieder, E. Brenner, S. Assmann, M. Hahn, M. Alkhaled, K. Schilbach, F. Essmann, M. Kneilling, C. Griessinger, et al., T-helper-1-cell cytokines drive cancer into senescence, Nature 494 (7437) (2013) 361-365.
[50] R. Kennedy, E. Celis, Multiple roles for CD4+ T cells in anti-tumor immune responses, Immunol. Rev. 222 (2008) 129-144.