Производные артемизинина подавляют эпителиальные раковые клетки яичников посредством остановки клеточного цикла опосредованной аутофагией
Boning Li†, Shixia Bu†, Junyan Sun, Ying Guo, and Dongmei Lai*
Международная больница материнства и детского здоровья, медицинский факультет Шанхайского университета Джао Тонг, Шанхай, 200030, Китай
Эти авторы внесли равнозначный вклад в данную работу.
*Адрес для корреспноденции. Тел./факс: +86-21-64070434; Электронная почта laidongmei@hotmail.com
Получено 04 апреля 2018 г.; Редакционное решение от 06 августа 2018 г.
Аннотация
Эпителиальный рак яичников (EOC) является наиболее смертельным гинекологическим злокачественным новообразованием по причине поздней диагностики и отсутствия лечебной терапии. Противомалярийное соединение артемизинин и его производные, такие как артесунат (ART) и дигидроартемизинин (DHA), оказались мощными противораковыми препаратами и действуют через различные противораковые механизмы. Чтобы идентифицировать новые мишени для производных артемизинина в клетках EOC, мы исследовали эффекты ART и DHA на рост SKOV3 и первичных клеток EOC с помощью анализа CCK-8. И ART, и DHA подавляли рост клеток EOC. Анализ распределения клеточного цикла показал, что ART и DHA вызывают остановку клеточного цикла G2/M. Более того, ART и DHA индуцировали аутофагию в клетках EOC, тогда как ингибиторы аутофагии обращали вспять ингибирование роста клеток и остановку клеточного цикла, вызванные ART и DHA. Вестерн-блоттинг показал, что ART и DHA также подавляли связанный с клеточным циклом путь передачи сигналов NF-кB в клетках EOC. Эти данные предполагают, что производные артемизинина вызывают аутофагию, блокируют клеточный цикл и подавляют рост клеток в клетках EOC. Наши исследования предоставляют новые цели для производных артемизинина для лечения EOC.
Ключевые слова: эпителиальный рак яичников, артемизинин, клеточный цикл, аутофагия
Введение
Эпителиальный рак яичников (EOC) является четвертой по частоте причиной смерти от рака у женщин и наиболее смертельным гинекологическим раком с плохим прогнозом и 5-летней выживаемостью всего 40% [1].bookmark23. Хирургия может уменьшить количество опухолей, обеспечить гистопатологический диагноз и установить стадию рака по классификации Международной федерации акушерства и гинекологии (FIGO). Большинство пациентов с запущенным заболеванием сначала получают положительный эффект от химиотерапии на основе платины, но рецидив наступает в течение 18 месяцев. [2,3]. Были предприняты попытки улучшить терапевтическую эффективность. Например, ингибиторы фактора роста эндотелия сосудов, такие как бевацизумаб, используются для антиангиогенной терапии [4]. Наномедицина применялась для ввода лекарственных средств для более эффективных результатов химиотерапии [5]. Однако выживаемость пациентов мало изменилась за последние несколько десятилетий [6]. Поэтому важно изучить альтернативные противоопухолевые стратегии.bookmark27, bookmark28, bookmark20.
Все больше доказательств подчеркивает противораковый потенциал артемизинина и его производных [7]. Артемизинин, открытый 1970-х годах группой Ту Юю в качестве противомалярийного препарата, показывает высокую эффективность и низкую токсичность [8]. Полусинтетические производные, включая артеметер, артесунат (ART) и дигидроартемизинин (DHA), более растворимы и стабильны. Кроме того, были синтезированы новые производные и продемонстрированы их свойства в качестве противоопухолевых агентов [9]. В нескольких статьях сообщалось о противоопухолевом действии производных артемизинина на рак яичников, и были выяснены возможные механизмы.bookmark29, bookmark30, bookmark31. Wang et al. [10] сообщили, что ART индуцировал окислительный стресс и двухцепочечные разрывы ДНК, подавлял уровень гомологичного рекомбинационного белка репарации RAD51 и, следовательно, повышал чувствительность клеток рака яичников к цисплатину. DHA ингибирует адгезию, инвазию и миграцию клеток EOC in vitro, а также их рост и метастазирование in vivo.bookmark32.
© Автор(ы). 2018 Опубликовано Oxford University Press от имени Института биохимии и клеточной биологии, Шанхайского института биологических наук Академии наук Ктиая. Все права защищены. Для получения разрешений просим направить письмо по электронному адресу: journals.permissions@oup.com
[11]. Кроме того, вызванные ART эффекты повреждения ДНК и гибели клеток могут быть частично зависимы от активных форм кислорода (АФК) при раке яичников [12].bookmark34
Аутофагия – процесс аутолиза, при котором клеточные компоненты изолируются в двухмембранные везикулы, а затем разрушаются в лизосомах [13]. Аутофагия играет важную роль в метаболизме опухолевых клеток, поскольку в раковых клетках часто возникает недостаток кислорода и питательных веществ [14]. Остается спорным вопрос о роли аутофагии при раке. Артемизинин и его производные, по-видимому, являются индукторами аутофагии при раке [15]. Однако не сообщалось, участвует ли аутофагия в механизме анти-EOC производных артемизинина. bookmark35, bookmark36, bookmark37
В настоящем исследовании мы оценили влияние производных артемизинина ART и DHA на ингибирование роста клеток и остановку клеточного цикла как в клетках SKOV3, так и в первично культивируемых клетках EOC. Мы обнаружили, что ART и DHA вызывают противоопухолевые эффекты и индуцируют аутофагию в клетках EOC, что может привести к остановке клеточного цикла. Более того, связанный с клеточным циклом сигнальный путь NF-кB ингибируется в клетках EOC производными артемизинина. Эти результаты предполагают, что производные артемизинина могут быть новой мишенью для лечения EOC.
Материалы и методы
Клеточная культура и реагенты
Клеточная линия рака яичников SKOV3 была получена из Шанхайского банка клеток Академии наук Китая (Шанхай, Китай). Первичные клетки EOC были получены от одного образца пациента, который был отнесен к серозной аденокарциноме стадии III, степени 2-3 в соответствии с Международной классификацией FIGO. Настоящее исследование было одобрено институциональным наблюдательным советом Шанхайского университета Джао Тонг, и было получено информированное согласие от пациентки международной больницы материнства и здоровья ребенка (Шанхай, Китай). Образец ткани пациента нарезали и инкубировали с 0,25% трипсином-ЭДТА (Biological Industries, Kibbutz Beit Haemek, Израиль) при температуре 37 °C для расщепления. Затем суспензию фильтровали и центрифугировали для сбора клеток. Первичные клетки EOC, использованные в экспериментах, подверглись менее чем 10 посевам. Клетки культивировали в среде Игла, модифицированной по Дульбекко (DMEM) (HyClone, Юта, США) с высоким содержанием глюкозы, с добавлением 10% фетальной бычьей сыворотки (Biological Industries) и 100 ед/мл пенициллинстрептомицина (Yeasen, Шанхай, Китай) в увлажненной среде. с 5% CO2 при 37 °C. ART и DHA были приобретены у Sigma-Aldrich (Сент-Луис, США). ART растворяли в бидистиллированной воде. Сначала DHA растворяли в диметилсульфоксиде (DMSO) и разбавляли до рабочих концентраций бидистиллированной водой. Конечная концентрация DMSO в среде была < 0,1%. Хлорохин (CQ), бафиломицин A (BAF) и рапамицин были приобретены в Sangon Biotech (Шанхай, Китай).
Анализ ССК-8
Жизнеспособность клеток оценивали с помощью набора для подсчета клеток-8 (CCK-8) (Yeasen) в соответствии с инструкциями производителя. Раковые клетки собирали и высевали в 96-луночные планшеты по 5000 клеток на лунку. Клетки культивировали в течение ночи, а предыдущую среду отбрасывали. Растворы ART и DHA с ингибиторами аутофагии или без них добавляли градиентами. Через 24 часа измерялась жизнеспособность клеток.
Анализ клеточного цикла
Клетки культивировали с производными артемизинина или без них в течение 24 ч, собирали, промывали фосфатным буферным солевым раствором (PBS) и фиксировали в 70% этаноле при температуре -20 °C в течение ночи. Затем клетки обрабатывали 0,1 мг/мл РНКазы A (Yeasen) и окрашивали йодидом пропидия (PI) (KeyGEN, Нанкин, Китай) в соответствии с протоколами производителя. Образцы анализировали в трех экземплярах, и клетки подвергали анализу клеточного цикла с помощью проточного цитометра (BD Accuri C6; BD Biosciences, Нью-Джерси, США).
Анализ по апоптозу
Набор для обнаружения апоптоза Annexin V-FITC/PI (40302ES20; Yeasen) использовали для его обнаружения. После получения назначенных обработок клетки расщепляли трипсином (Lonza, Базель, Швейцария), а затем центрифугировали (4 °C, 300 г, 5 минут) для сбора. Затем клетки дважды промывали ледяным PBS и 105 клеток суспендировали в 100 мкл 1x буфера для связывания и инкубировали с 5 мкл аннексина V-FITC и 10 мкл PI в течение 15 минут в темноте при комнатной температуре. Затем добавляли 400 мкл связывающего буфера и измеряли скорость апоптоза клеток с помощью проточного цитометра.
Вестерн-блоттинг
Белок экстрагировали из клеточных лизатов с использованием буфера для анализа радиоиммунопреципитации (Beyotime, Шанхай, Китай), и концентрации определяли количественно с использованием набора для анализа бицинхониновой кислоты (Boster, Ухань, Китай). Вестерн-блоты получали с использованием стандартных протоколов. Антитела против LC3 (wl01506; Wanleibio, Шэньян, Китай), p65 (8242T; CST), p-p65 (3033T; CST), Beclin-1 (4122S; CST), Atg5 (wl02411; Wanleibio) и β-тубулина (30303ES10; Yeasen) использовали в качестве первичных антител. Набор для улучшения хемилюминесценции (New Cell & Molecular Biotech Co., Сучжоу, Китай) применяли для визуализации блотов. Результаты количественно оценивали с помощью программного обеспечения ImageJ (NIH, Мэриленд, США).
Трансфекция плазмиды GFP-LC3 и анализ аутофагического потока
Клетки высевали на чашки со стеклянным дном (In Vitro Scientific, Mountain View, США). После ночного культивирования их трансфицировали плазмидой GFP-LC3 (подаренной доктором Джунлином Гуаном из Университета Цинциннати) при 80% слиянии с использованием реагента Lipofectamine 3000 (Thermo Fisher Scientific Inc., Уолтем, США). Спустя двадцать четыре часа клетки обрабатывали ART или DHA, и группу рапамицина использовали в качестве положительного контроля. Еще через 24 часа для каждой группы определяли количество ячеек с точкой GFP-LC3 в трех случайных полях зрения. Изображения получали с помощью конфокального микроскопа Leica Application Suite X (LASX) (Leica TCS SP8, Вецлар, Германия).
Трансфекция миРНК
Клетки трансфицировали миРНК с использованием реагента Lipofectamine 3000 в соответствии с инструкциями производителя. Последовательность отрицательного контроля (NC) (смысл: 5'-UUCUCCGAACGUGUCACGUTT-3', антисмысл: 5'-ACGUGACACGUUCGGAGAATT-3') и последовательность миРНК Atg5 (смысл: 5'-GCAACUCUGGAUGGGAUUGUU sense-3 ', антисмысл: : 5'-CAAUCCCAUCCAGAGUUGCUU-3') были описаны ранее. [16]. миРНК была синтезирована GenePharma Co. (Шанхай, Китай). Затем клетки инкубировали в течение 24 часов и подвергали вестерн-блоттингу или анализу жизнеспособности клеток.
Статистический анализ
Для анализа данных использовался t-критерий Стьюдента. P-значения были рассчитаны с использованием GraphPad Prism версии 6 (GraphPad Software, Ла-
Холья, США). Различия считались статистически значимыми при P < ,05.
Результаты
Производные артемизинина подавляют рост клеток EOC, вызывая остановку клеточного цикла G2/M
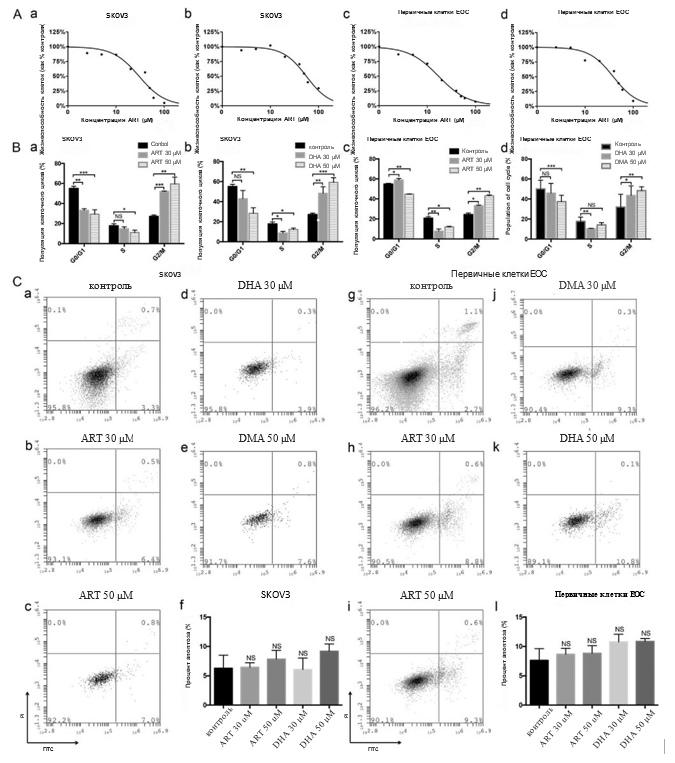
Для проверки противоопухолевого действия производных артемизинина на клетки EOC, мы выбрали ART и DHA, которые обычно используются в исследованиях рака [17]. Анализ жизнеспособности клеток CCK-8 использовали для исследования активности ингибирования роста двух производных против линии клеток рака яичников человека SKOV3 и первичной культуры клеток EOC. Раковые клетки культивировали в полной среде с различными концентрациями ART или DHA (0, 2,5, 5, 10, 20, 40, 50, 60 и 100 мкМ). Было обнаружено, что жизнеспособность клеток снижалась дозозависимым образом в раковых клетках яичников, обработанных производным артемизинина (рис. 1A). bookmark39, bookmark16
Чтобы определить, вызвано ли ингибирование роста клеток производными артемизинина остановкой клеточного цикла, к клеткам EOC добавляли 0, 30 или 50 мкМ ART или DHA, а распределение клеточного цикла анализировали с помощью проточной цитометрии. Как показано на рис. 1B, по сравнению с контрольной группой доля клеток в фазе G2/M была значительно увеличена после обработки ART или DHA как в клетках SKOV3, так и в первичных клетках EOC. Эти эффекты также были дозозависимыми, что позволяет предположить, что производные артемизинина могут вызывать остановку клеточного цикла. bookmark16
Затем мы проверили, участвует ли апоптоз в дезактивации клеток EOC. Анализ окрашивания аннексином-V/PI показал, что процентное содержание апоптотических клеток было одинаковым в группах, обработанных производным артемизинина, и в контрольной группе (рис. 1C). Эти результаты продемонстрировали, что производные артемизинина останавливают клеточный цикл клеток EOC в фазе G2/M, но не вызывают явного апоптоза, указывая на то, что ингибирование роста клеток может быть связано с остановкой клеточного цикла (дополнительный рисунок S1C). bookmark16
Производные артемизинина вызывают аутофагию в клетках EOC
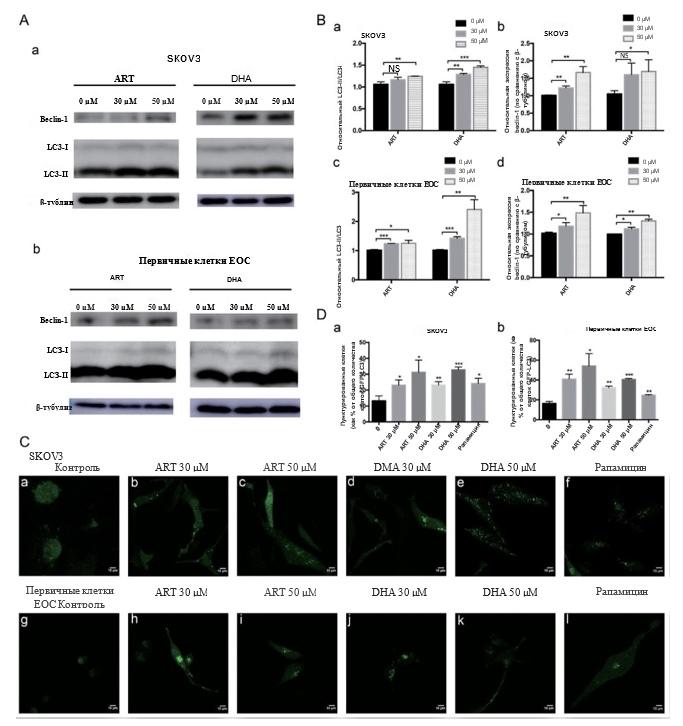
Аутофагия – это запрограммированный процесс, в ходе которого разрушаются клеточные белки и органеллы. Это основной клеточный путь, реагирующий на изменения окружающей среды [18]. Gong et al. [19] обнаружили, что индукция аутофагии может остановить переход G2/M за счет активации p21, ингибитора циклин-зависимой киназы, в клетках рака поджелудочной железы, клетках рака молочной железы и клетках рака легких, предполагая, что аутофагия может играть роль в клеточном цикле. регулирование. Превращение LC3 из LC3-I в LC3-II является надежным маркером аутофагии [20]. bookmark40, bookmark41, bookmark42. Затем мы исследовали, может ли аутофагия в клетках EOC быть вызвана производными артемизинина. ART и DHA в концентрациях 0, 30 и 50 мкМ использовали для обработки клеток EOC в течение 24 часов, а уровень аутофагии анализировали с помощью вестерн-блоттинга. Клетки EOC обрабатывали различными концентрациями ART или DHA в течение 24 часов. Высокие соотношения LC3-II/LC3-I наблюдались как в клетках SKOV3, так и в первичных клетках EOC (рис. 2A, B). Кроме того, индукция аутофагии зависела от дозы. bookmark17. Другой маркер аутофагии, Beclin-1, также был исследован, и было обнаружено, что он повышен в обработанных ART/DHA клетках EOC, что указывает на активацию аутофагии (рис. 2A, B). bookmark17
Для дальнейшего подтверждения стимуляции аутофагии мы трансфицировали клетки экспрессирующими плазмидами GFP-LC3. Активатор аутофагии рапамицин (0,5 мкМ) использовали в качестве положительного контроля. В условиях активации аутофагии образуются точечные флуоресцентные структуры, свидетельствующие об образовании аутофагосом. После инкубации с производными артемизинина как клетки SKOV3, так и первичные клетки EOC образовывали яркие точки GFP-LC3, и наблюдался высокий процент положительных точек клеток (рис. 2C, D). Эти результаты показали, что производные артемизинина могут вызывать аутофагию в клетках EOC при различных концентрациях. bookmark17.
Анти-EOC эффекты производных артемизинина устраняются ингибитором аутофагии.
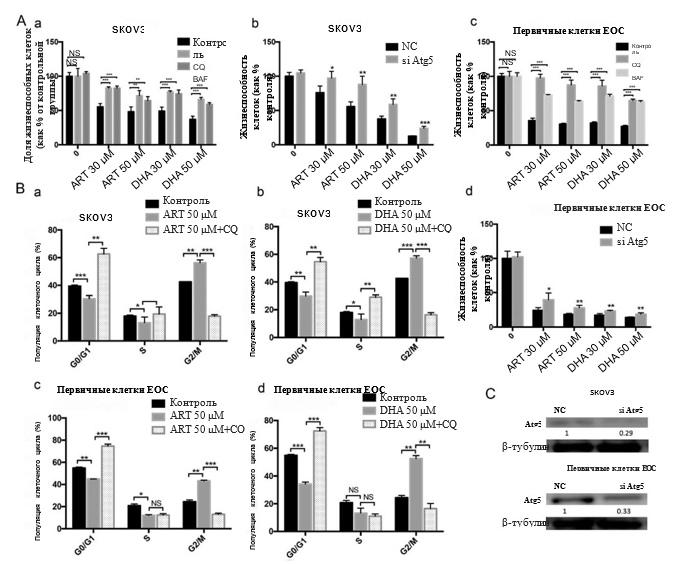
Чтобы подтвердить, является ли аутофагия вышестоящим механизмом остановки G2/M, вызванной производным артемизинина, в клетках EOC, мы обрабатывали клетки EOC производными артемизинина (0, 30 и 50 мкМ) в сочетании с CQ и BAF, двумя ингибиторами аутофагии. In vitro, 50 мкМ CQ или 50 нМ BAF эффективно ингибируют аутофагию в клетках рака яичников (дополнительный рисунок S1A, B, D) [21]. Как показано на рис. 3A, только обработка производными артемизинина снижает жизнеспособность клеток; однако, когда были добавлены ингибиторы аутофагии, жизнеспособность клеток EOC значительно увеличилась. Мы также исследовали, может ли блокирование аутофагии путем отключения Atg5, важного гена аутофагии, с помощью миРНК увеличить процент выживания (рис. 3A, b, d). bookmark43 Эффективность нокдауна оценивали с помощью вестерн-блоттинга (рис. 3С). Результаты продемонстрировали, что ингибирование роста клеток EOC, вызванное производными артемизинина, снижалось при прерывании аутофагии.
Кроме того, мы проверили, может ли подавление аутофагии прервать остановку клеточного цикла, вызванную производными артемизинина. Как описано выше, 50 мкМ ART или DHA было достаточно, чтобы вызвать задержку G2/M в клетках EOC; таким образом, к клеткам EOC добавляли 50 мкМ ART или DHA в комбинации с CQ или без него. Результаты показали, что ART и DHA индуцировали остановку фазы G2/M в SKOV3 и первичных клетках EOC, но когда производные артемизинина использовались в сочетании с CQ, доля клеток EOC в фазе G2/M была значительно снижена (рис. 3B и дополнительный рис. S1C). Эти результаты показали, что остановка клеточного цикла, вызванная производными артемизинина, может частично зависеть от регуляции аутофагии в клетках EOC.
Производные артемизинина регулируют путь NF-кB через аутофагию
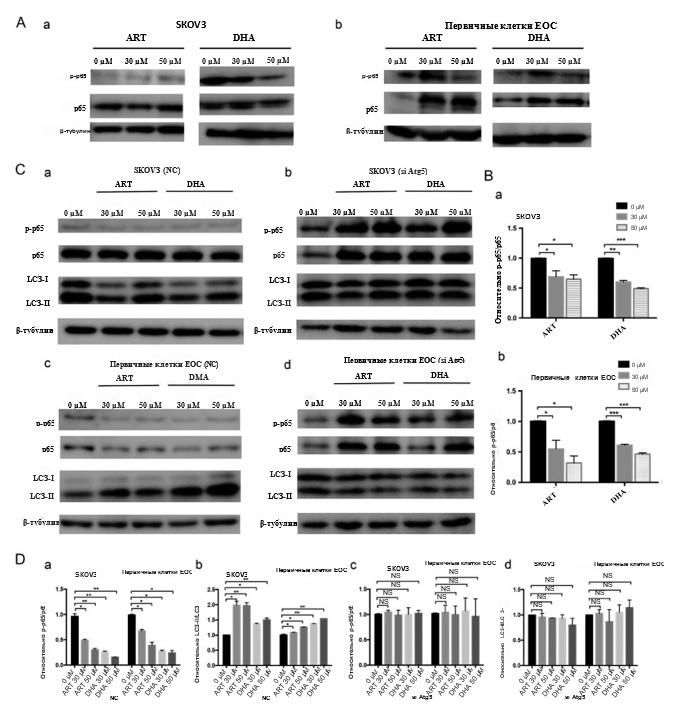
Затем мы измерили, могут ли производные артемизинина регулировать путь передачи сигналов NF-кB. Принято считать, что при активации пути передачи сигналов NF-кB p65 фосфорилируется до p-p65, а затем перемещается из цитоплазмы в ядро для активации генов-мишеней [22]. Следовательно, снижение уровня p-p65 является индикатором подавления NF-кB. SKOV3 и первичные клетки EOC обрабатывали ART (0, 30 или 50 мкМ) или DHA (0, 30 и 50 мкМ) в течение 24 часов, а затем анализировали уровни белка p65 и p-p65 с помощью вестерн-блоттинга.bookmark44. Как показано на рис. 4A, B, соотношение белка p-p65/p65 в SKOV3 и первичных клетках EOC уменьшилось после обработки 30 и 50 мкМ ART или DHA, что указывает на то, что производные артемизинина снижали уровень фосфорилирования белка p65 в EOC. клетки. Таким образом, производные артемизинина подавляли сигнальный путь NF-кB в клетках EOC. bookmark19.
Затем мы заблокировали аутофагию с помощью миРНК против Atg5. Отношения p-p65/p65 и LC3-II/LC3-I измеряли с помощью вестерн-блоттинга для исследования изменений в сигнальном пути NF-кB и уровнях аутофагии, соответственно. Относительное соотношение LC3-II/LC3-I увеличивалось в группе NC, но оставалось довольно стабильным в группе siAtg5; Напротив, соотношение p-p65/p65 было уменьшено в группе NC, но не было значительной разницы в группе siAtg5 (рис. 4C, D). Результаты показали, что после нокдауна Atg5 ни ART, ни DHA не могли активировать аутофагию в клетках EOC, bookmark19.
Рисунок 1. Производные артемизинина подавляли рост EOC и останавливали клеточный цикл в фазе G2/M (A) Клетки SKOV3 и первичного эпителиального рака яичников (EOC) обрабатывали различными концентрациями производных артемизинина артесуната (ART) и дигидроартемизинина (DHA) в течение 24 часов. Анализ CCK-8 показал, что ART (a, c) и DHA (b, d) вызывают дозозависимое ингибирование жизнеспособности клеток в обеих клеточных линиях (n = 6). (B) Пропорции клеток в различных фазах клеточного цикла были проанализированы с помощью проточной цитометрии для линии клеток SKOV3 (a, b) и первичных клеток EOC (c, d) (n = 3, выполнено в трех экземплярах). Клетки обрабатывали 0, 30 и 50 мкМ ART (a, c) или DHA (b, d) в течение 24 часов. И ART, и DHA увеличивали процент популяции клеток в фазе G2/M в клетках SKOV3 (a, b) и первичных клетках EOC (c, d). Диаграммы анализа проточной цитометрии показаны на дополнительном рисунке S1C. (C) Апоптозные клетки (аннексин-V-положительный и пропидий-йодид (PI) -отрицательный для раннего апоптоза и аннексин-V-положительный и Pl-положительный для позднего апоптоза) анализировали с помощью проточной цитометрии. Клетки SKOV3 (a-f) и первичные клетки EOC (g-1) обрабатывали 30 мкМ или 50 мкМ ART или DHA, что вызывало остановку клеточного цикла. Ось абсцисс представляет флуоресценцию аннексина-V-FITC, а ось ординат представляет флуоресценцию PI. Оценивали скорость апоптоза (f, l). Значимого апоптоза не наблюдалось. Данные представлены как среднее ± стандартное отклонение. *P < 0,05, **P < 0,01, ***P < 0,001. NS — незначительно.
Рисунок 2. Аутофагия индуцировалась производными артемизинина в клетках EOC (A). Был проведен вестерн-блоттинг, чтобы проверить влияние АРТ и DHA на уровни белков маркеров аутофагии LC3 и Beclin-1. После обработки производным артемизинина клеток SKOV3 (a) и первичных клеток EOC (b) наблюдалось повышение уровня Beclin-1 и соотношения LC3-II/LC3-I, что свидетельствует о том, что ART и DHA индуцировали аутофагию в клетках EOC. (B) Были оценены значения оттенков серого для вестерн-блотов. Количество загруженного белка было нормализовано по β-тубулину. Соотношение LC3-II/LC3-I и относительная интенсивность Beclin-1 были стандартизированы относительно контрольной группы. Были рассчитаны различия между группами, и эксперименты были выполнены в трех повторностях. (C) Типичные изображения GFP-
Окрашивание LC3 в SKOV3 (a-f) и первичных клетках EOC (g-l), инкубированных в течение 24 часов в отсутствие (a, g) или в присутствии ART (b, c, h, i) или DHA (d, e, j, k). Рапамицин использовали в качестве положительного контроля для индукции аутофагии (f, l). Яркая точка GFP-LC3 указывает на скопление аутофагических вакуолей. Стержень, 10 мкм. (D) Был определен процент клеток с точечным окрашиванием GFP-LC3. Подобно группе рапамицина, АРТ и ДГК приводили к большему количеству пункта-положительных клеток, что указывает на индукцию аутофагии. Данные показаны как среднее ± стандартное отклонение. *P < 0,05, ** P < 0,01, ***P < 0,001. NS — незначительно.
Рисунок 3. Ингибирование роста клеток, вызванное производными артемизинина, было отменено ингибиторами аутофагии в клетках EOC (A). Ингибиторы аутофагии хлорохин (CQ) и бафиломицин (BAF) были использованы для определения того, является ли аутофагия ответственной за ингибирование роста раковых клеток, вызванное производным артемизинина. Клетки SKOV3 (a) и первичные клетки EOC (c) обрабатывали различными концентрациями АРТ или DHA с ингибиторами аутофагии или без них. Кроме того, клетки SKOV3 (b) и первичные клетки EOC (d) трансфицировали отрицательным контролем (NC) или миРНК Atg5 в течение 24 часов, а затем обрабатывали ART или DHA в течение еще 24 часов. Анализы CCK-8 показали, что CQ, BAF и трансфекция миРНК Atg5 противодействовали ингибированию роста клеток, индуцированному ART или DHA (n = 6). (B) Распределение клеточного цикла было проанализировано с помощью проточной цитометрии (n = 3, выполнено в трех экземплярах). По сравнению с группами, получавшими производное артемизинина, добавление CQ блокировало остановку фазы G2/M, вызванную производными артемизинина в клетках SKOV3 (a, b) и первичных клетках EOC (c, d). (C) Экстракты клеток подвергали вестерн-блоттингу с использованием антитела против Atg5. Относительная интенсивность Atg5 была стандартизирована по отношению к группе NC. Данные представлены как среднее ± стандартное отклонение. *P < 0,05, **P < 0,01, ***P < 0,001. NS — незначительно.
и путь передачи сигналов NF-кB не мог быть ингибирован. Следовательно, аутофагия, вызванная производным артемизинина, может ингибировать сигнальный путь NF-кB- в клетках EOC.
Обсуждение
В этом исследовании мы продемонстрировали, что возможный механизм, участвующий в цитотоксичности производных артемизинина при раке яичников, основан на индукции аутофагии. Аутофагия запускает остановку G2/M в клетках EOC, тем самым подавляя рост клеток EOC. Наши результаты показывают, что аутофагия, вызванная производным артемизинина, играет роль в остановке клеточного цикла EOC, и предоставляют новые доказательства того, что аутофагия может быть потенциальной мишенью для терапии рака яичников.
Потеря контроля клеточного цикла является одним из отличительных признаков раковых клеток и приводит к неконтролируемой пролиферации опухолей [23]. Таким образом, клеточный цикл стал целью лечения рака [24,25]. Сообщалось, что производные артемизинина регулируют цикл раковых клеток. Сообщалось, что DHA вызывает остановку клеточного цикла G2/M при раке головы и шеи, и этот эффект опосредуется белком Forkhead box M1 [26]. Артемизинин снижает функцию Sp1, подавляет экспрессию CDK4 и запускает остановку клеточного цикла G1 в клетках рака простаты человека [27]. bookmark45, bookmark46, bookmark47, bookmark48, bookmark49. Здесь нами было обнаружено, что разные концентрации АРТ и ДГК могут ингибировать рост клеток EOC и вызывать остановку клеточного цикла G2/M без индукции апоптоза, предполагая, что остановка клеточного цикла, вызванная АРТ и DHA, может объяснять ингибирование клеток EOC (рис. 1). bookmark16.
Рисунок 4. Сигнальный путь NF-кB ингибировался производными артемизинина в клетках EOC (A). Фосфорилирование p65 указывает на активацию пути передачи сигнала NF-kB. SKOV3 (a) и первичные клетки EOC (b) обрабатывали 0, 30 и 50 мкМ ART или DHA в течение 24 часов; затем относительные уровни экспрессии белков p65 и p-p65 исследовали с помощью вестерн-блоттинга. Количество загруженного белка нормализовали по β-тубулину, и эксперименты проводили в трех повторностях. (B) Были оценены значения оттенков серого для вестерн-блотов. Отношение p-p65/p65 снижалось дозозависимым образом через 24 ч после обработки ART или DHA в клетках SKOV3 (a) и первичных клетках EOC (b). Соотношение p-p65/p65 было стандартизировано по отношению к контрольной группе, и были рассчитаны различия между группами. Эксперименты проводили в трех повторностях. (C) Клетки SKOV3 (a, b) и первичные клетки EOC (c, d) были временно трансфицированы миРЕНК против Atg5, а затем обработаны производными артемизинина в различных концентрациях в течение 24 часов. Был проведен вестерн-блоттинг для определения уровней белка p-p65, p65 и LC3.Количество загруженного белка нормализовали по β-тубулину, и эксперименты проводили в трех повторностях. (D) Были оценены значения оттенков серого вестерн-блоттинга. Соотношения p-p65/p65 и LC3-II/LC3-I стандартизированы по отношению к контрольной группе. Относительное соотношение LC3-II/LC3-I увеличивалось в группе NC, но оставалось стабильным в группе siAtg5. Напротив, соотношение p-p65/p65 было уменьшено в группе NC, но не было значительной разницы между контрольной группой и группой siAtg5.Данные представлены как среднее значение ± стандартное отклонение. *P < 0,05, **P < 0,01, *** P < 0,001.
Согласно текущим исследованиям, аутофагия может быть вызвана артемизинином и его производными в раковых клетках; однако неясно, есть ли цель в этом противоопухолевом эффекте. Ganguli et al. [28] сообщили, что предварительная обработка CQ имела синергетический эффект на лечение АРТ в клетках немелкокостной карциномы легкого. В исследовании линии клеток шейки матки человека HeLa ингибирование аутофагии с помощью CQ усиливало противоопухолевые эффекты DHA [29]. Feng et al. [30] сообщили, что DHA индуцирует аутофагию в клетках рака яичников; однако подавление аутофагического потока не уменьшало гибель раковых клеток.bookmark50, bookmark51, bookmark52. Здесь мы наблюдали, что производные артемизинина ART и DHA могут вызывать аутофагию в клетках EOC при различных концентрациях (рис. 2), и противоопухолевые эффекты этих производных артемизинина могут быть отменены ингибиторами аутофагии (рис. 3). Согласно этим результатам можно предположить, что индукция аутофагии может быть механизмом, лежащим в основе противоопухолевых эффектов производных артемизинина, таким образом раскрывая потенциальный новый механизм действия противомалярийных препаратов при раке яичников. bookmark17.
NF-кB может подавлять пути гибели клеток, уменьшать апоптоз и способствовать росту клеток; таким образом, он широко признан в качестве промотора опухоли [31]. В настоящем исследовании мы подтвердили, что сигнальный путь NF-кB может быть подавлен с помощью АРТ и DHA в клетках EOC, и блокирование аутофагии устранило эту модуляцию (рис. 4), предполагая, что аутофагия, индуцированная производными артемизинина, может приводить к NF- кB торможение. Кроме того, сообщается, что сигнальный путь NF-кB связан с регуляцией клеточного цикла. Cude et al. [32] продемонстрировали, что транскрипция, опосредованная NF-кB, регулирует прогрессию G2/M. bookmark53, bookmark19, bookmark54. Ингибирование NF-кB задерживает митотический вход и ингибирует транскрипцию некоторых критических генов, участвующих в фазе G2/M. В клетках, подвергающихся гепатоканцерогенезу, опосредованное бутазеленом ингибирование пути NF-кB может приводить к остановке G2 / M [33]. Таким образом, индуцированное аутофагией ингибирование NF-кB может быть связано с остановкой G2/M в EOC-клетках, обработанных производным артемизинина. bookmark55
Вопрос о том, является ли аутофагия способствующей или противостоящей раку, остается спорным. Аутофагия может действовать как защитный механизм при раке в ответ на стресс, например, поддерживая раковые стволовые клетки и индуцируя химиорезистентность [34]. Кроме того, сообщалось, что блокирование аутофагии усиливает действие цисплатина на клетки рака яичников, подавляющие BRCA2 [35]. Однако существуют доказательства того, что аутофагия играет роль в подавлении рака яичников. Ресвератрол способен эпигенетически активировать аутофагию при раке яичников, вызывая эффекты ингибирования миграции [36].bookmark56, bookmark57, bookmark58. Lu et al. [37] обнаружили, что гибель аутофагических клеток происходит, когда аутофагия индуцируется до определенного уровня в клетках SKOV3. Фосфопротеин массой 15 кДа, обогащенный фосфором белок в астроцитах (PEA-15), вызывает аутофагию при раке яичников, а высокий уровень экспрессии PEA-15 положительно коррелирует с более длительным выживанием пациентов [38]. Сообщалось, что ализертиб, селективный ингибитор киназы Aurora A, задерживает клетки SKOV3 и OVCAR4 в фазе G2/M и способствует аутофагии [39]. Было обнаружено, что комбинация децитабина и субероиланилид гидроксамовой кислоты индуцирует аутофагию и подавляет рост раковых клеток в клеточных линиях рака яичников (HEY и SKOV3) [40]. bookmark59, bookmark60, bookmark61, bookmark62. Кроме того, нокдаун гена RAB25 с помощью миРНК может вызывать аутофагию в клетках рака яичников HEY и ES-2 и увеличивать долю клеток в фазе G0/G1 [41]. В соответствии с этими результатами, наши результаты также предполагают, что возможно подавление раковых клеток яичников путем индукции аутофагии. bookmark63.
Все больше данных показывает, что производные артемизинина обладают большим потенциалом в качестве противоопухолевых средств. Поскольку существует множество мишеней противоопухолевых эффектов производных артемизинина, стоит искать комбинации методов лечения рака. Например, АРТ повышает чувствительность клеток глиобластомы к цитотоксичности темозоломида [42]. bookmark64. Взаимодействие между галофугиноном и артемизинином оказывает синергетический противораковый эффект в различных раковых клетках, регулируя клеточный цикл [43]. Здесь мы демонстрируем, что ингибитор аутофагии CQ противодействует ингибированию клеток EOC, вызванному ART и DHA. Однако следует продолжить изучение вопроса о том, могут ли производные артемизинина в сочетании с другими противораковыми агентами повысить эффективность противоопухолевой терапии. Кроме того, стоит изучить, подавляют ли производные артемизинина EOC клетки другими путями, когда аутофагия блокируется [44]. bookmark65, bookmark66.
В заключение, производные артемизинина индуцируют аутофагию в клетках EOC, тем самым блокируя клеточный цикл и в конечном итоге подавляя рост раковых клеток. Наше исследование выявило новую мишень для артемизинина в лечении EOC.
Дополнительные данные
Дополнительные данные доступны на сайте Acta Biochimica et Biophysica Sinica онлайн.
Финансирование
Работа поддержана грантами Шанхайского муниципального совета по науке и технологиям (№ 14411961500), Шанхайской муниципальной комиссией по образованию – Клиническая медицина Гаофэн (№ 20152236) и Фонда медицинской инженерии Шанхайского университета Джао Тонг (№ YG2015ZD11).
Библиографический список
- Jacobs IJ, Menon U, Ryan A, Gentry-Maharaj A, Burnell M, Kalsi JK, Amso NN, et al . Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. Lancet 2016, 387: 945-956.
- Kehoe S, Hook J, Nankivell M, Jayson GC, Kitchener H, Lopes T, Luesley D, et al. Primary chemotherapy versus primary surgery for newly diagnosed advanced ovarian cancer (CHORUS): an open-label, randomised, controlled, non-inferiority trial. Lancet 2015, 386: 249-257.
- Jayson GC, Kohn EC, Kitchener HC, Ledermann JA. Ovarian cancer. Lancet 2014, 384: 1376-1388.
- Jayson GC, Kerbel R, Ellis LM, Harris AL. Antiangiogenic therapy in oncology: current status and future directions. Lancet 2016, 388: 518-529.
- He C, Liu D, Lin W. Nanomedicine applications of hybrid nanomaterials built from metal-ligand coordination bonds: nanoscale metal-organic frameworks and nanoscale coordination polymers. Chem Rev 2015, 115: 11079-11108.
- Vaughan S, Coward JI, Bast RC Jr, Berchuck A, Berek JS, Brenton JD, Coukos G, et al. Rethinking ovarian cancer: recommendations for improving outcomes. Nat Rev Cancer 2011, 11: 719-725.
- Bhaw-Luximon A, Jhurry D. Artemisinin and its derivatives in cancer therapy: status of progress, mechanism of action, and future perspectives. Cancer Chemother Pharmacol 2017, 79: 451-466.
- Wong YK, Xu C, Kalesh KA, He Y, Lin Q, Wong WSF, Shen HM, et al. Artemisinin as an anticancer drug: recent advances in target profiling and mechanisms of action. Med Res Rev 2017, 37: 1492-1517.
- Magoulas GE, Tsigkou T, Skondra L, Lamprou M, Tsoukala P, Kokkinogouli V, Pantazaka E, et al. Synthesis of nomicronvel artemisinin dimers with polyamine linkers and evaluation of their potential as anticancer agents. Bioorg Med Chem 2017, 25: 3756-3767.
- Wang B, Hou D, Liu Q, Wu T, Guo H, Zhang X, Zou Y, et al. Artesunate sensitizes ovarian cancer cells to cisplatin by downregulating RAD51. Cancer Biol Ther2015, 16: 1548-1556.
- Wu B, Hu K, Li S, Zhu J, Gu L, Shen H, Hambly BD, et al. Dihydroartiminisin inhibits the growth and metastasis of epithelial ovarian cancer. Oncol Rep 2012, 27: 101-108.
- Greenshields AL, Shepherd TG, Hoskin DW. Contribution of reactive oxygen species to ovarian cancer cell growth arrest and killing by the anti-malarial drug artesunate. Mol Carcinog 2017, 56: 75-93.
- Zhou S, Zhao L, Kuang M, Zhang B, Liang Z, Yi T, Wei Y, et al. Autophagy in tumorigenesis and cancer therapy: Dr. Jekyll or Mr. Hyde? Cancer Lett 2012, 323: 115-127.
- Levine B, Kroemer G. Autophagy in the pathogenesis of disease. Cell 2008, 132: 27-42.
- Jia G, Kong R, Ma ZB, Han B, Wang YW, Pan SH, Li YH, et al. The activation of c-Jun NH(2)-terminal kinase is required for dihydroartemisinin- induced autophagy in pancreatic cancer cells. J Exp Clin Cancer Res 2014, 33: 8.
- Wang Q, Xue L, Zhang X, Bu S, Zhu X, Lai D. Autophagy protects ovarian cancer-associated fibroblasts against oxidative stress. Cell Cycle 2016, 15: 1376-1385.
- Wang ZC, Liu Y, Wang H, Han QK, Lu C. Research on the relationship between artesunate and Raji cell autophagy and apoptosis of Burkitt's lymphoma and its mechanism. Eur Rev Med Pharmacol Sci 2017, 21: 2238-2243.
- Choi AM, Ryter SW, Levine B. Autophagy in human health and disease. N Engl J Med 2013, 368: 651 - 662.
- Gong FR, Wu MY, Shen M, Zhi Q, Xu ZK, Wang R, Wang WJ, et al. PP2A inhibitors arrest G2/M transition through JNK/Sp1-dependent down-regulation of CDK1 and autophagy-dependent up-regulation of p21. Oncotarget 2015, 6: 18469-18483.
- Klionsky DJ, Abdelmohsen K, Abe A, Abedin MJ, Abeliovich H, Acevedo Arozena A, Adachi H, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy 2016, 12: 1-222.
- Pagotto A, Pilotto G, Mazzoldi EL, Nicoletto MO, Frezzini S, Pasto A, Amadori A. Autophagy inhibition reduces chemoresistance and tumori- genic potential of human ovarian cancer stem cells. Cell Death Dis 2017, 8: e2943.
- Hoffmann A, Baltimore D. Circuitry of nuclear factor kappaB signaling. Immunol Rev 2006, 210: 171-186.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011, 144: 646-674.
- Tse AN, Carvajal R, Schwartz GK. Targeting checkpoint kinase 1 in cancer therapeutics. Clin Cancer Res 2007, 13: 1955 -1960.
- Rixe O, Fojo T. Is cell death a critical end point for anticancer therapies or is cytostasis sufficient? Clin Cancer Res 2007, 13: 7280 -7287.
- Lin R, Zhang Z, Chen L, Zhou Y, Zou P, Feng C, Wang L, et al. Dihydroartemisinin (DHA) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells. Cancer Lett 2016, 381: 165- 175.
- Willoughby JA Sr, Sundar SN, Cheung M, Tin AS, Modiano J, Firestone GL. Artemisinin blocks prostate cancer growth and cell cycle progression by disrupting Sp1 interactions with the cyclin-dependent kinase-4 (CDK4) promoter and inhibiting CDK4 gene expression. J Biol Chem 2009, 284: 2203-2213.
- Ganguli A, Choudhury D, Datta S, Bhattacharya S, Chakrabarti G. Inhibition of autophagy by chloroquine potentiates synergistically anticancer property of artemisinin by promoting ROS dependent apoptosis. Biochimie 2014, 107: 338-349.
- Chen SS, Hu W, Wang Z, Lou XE, Zhou HJ. p8 attenuates the apoptosis induced by dihydroartemisinin in cancer cells through promoting autophagy. Cancer Biol Ther 2015, 16: 770-779.
- Feng X, Li L, Jiang H, Jiang K, Jin Y, Zheng J. Dihydroartemisinin potentiates the anticancer effect of cisplatin via mTOR inhibition in cisplatin-resistant ovarian cancer cells: involvement of apoptosis and autophagy. Biochem Biophys Res Commun 2014, 444: 376-381.
- Hu W, Chen SS, Zhang JL, Lou XE, Zhou HJ. Dihydroartemisinin induces autophagy by suppressing NF-kappaB activation. Cancer Lett 2014, 343: 239-248.
- Cude K, Wang Y, Choi HJ, Hsuan SL, Zhang H, Wang CY, Xia Z. Regulation of the G2-M cell cycle progression by the ERK5-NFkappaB signaling pathway. J Cell Biol 2007, 177: 253-264.
- Zheng X, Ma W, Sun R, Yin H, Lin F, Liu Y, Xu W, et al. Butaselen prevents hepatocarcinogenesis and progression through inhibiting thioredoxin reductase activity. Redox Biol 2018, 14: 237-249.
- Zhang N, Qi Y, Wadham C, Wang L, Warren A, Di W, Xia P. FTY720 induces necrotic cell death and autophagy in ovarian cancer cells: a protective role of autophagy. Autophagy 2010, 6: 1157-1167.
- Wan B, Dai L, Wang L, Zhang Y, Huang H, Qian G, Yu T. Knockdown of BRCA2 enhances cisplatin and cisplatin-induced autophagy in ovarian cancer cells. Endocr Relat Cancer 2018, 25: 69-82.
- Ferraresi A, Phadngam S, Morani F, Galetto A, Alabiso O, Chiorino G, Isidoro C. Resveratrol inhibits IL-6-induced ovarian cancer cell migration through epigenetic up-regulation of autophagy. Mol Carcinog 2017, 56: 1164-1181.
- Lu Z, Luo RZ, Lu Y, Zhang X, Yu Q, Khare S, Kondo S, et al. The tumor suppressor gene ARHI regulates autophagy and tumor dormancy in human ovarian cancer cells. J Clin Invest 2008, 118: 3917-3929.
- Bartholomeusz C, Rosen D, Wei C, Kazansky A, Yamasaki F, Takahashi T, Itamochi H, et al. PEA-15 induces autophagy in human ovarian cancer cells and is associated with prolonged overall survival. Cancer Res 2008, 68: 9302-9310.
- Ding YH, Zhou ZW, Ha CF, Zhang XY, Pan ST, He ZX, Edelman JL, et al. Alisertib, an Aurora kinase A inhibitor, induces apoptosis and autophagy but inhibits epithelial to mesenchymal transition in human epithelial ovarian cancer cells. Drug Des Devel Ther 2015, 9: 425 -464.
- Chen MY, Liao WS, Lu Z, Bornmann WG, Hennessey V, Washington MN, Rosner GL, et al. Decitabine and suberoylanilide hydroxamic acid (SAHA) inhibit growth of ovarian cancer cell lines and xenografts while inducing expression of imprinted tumor suppressor genes, apoptosis, G2/ M arrest, and autophagy. Cancer 2011, 117: 4424 - 4438.
- Liu Y, Tao X, Jia L, Cheng KW, Lu Y, Yu Y, Feng Y. Knockdown of RAB25 promotes autophagy and inhibits cell growth in ovarian cancer cells. Mol Med Rep 2012, 6: 1006-1012.
- Berte N, Lokan S, Eich M, Kim E, Kaina B. Artesunate enhances the therapeutic response of glioma cells to temozolomide by inhibition of homologous recombination and senescence. Oncotarget 2016, 7: 67235-67250.
- Chen GQ, Gong RH, Shi XL, Yang DJ, Zhang G, Lu AP, Yue JB, et al. Halofuginone and artemisinin synergistically arrest cancer cells at the G1/ G0 phase by upregulating p21(Cip1) and p27(Kip1). Oncotarget 2016, 7: 50302-50314.
- Yu T, Yang Y, Zhang J, He H, Ren X. Circumvention of cisplatin resistance in ovarian cancer by combination of cyclosporin A and low- intensity ultrasound. Eur J Pharm Biopharm 2015, 91: 103-110.