Гибрид артемизинин-даумон ингибирует остеолиз, опосредованный раковыми клетками, воздействуя на раковые клетки и остеокласты
Gwang Taek Maa,b Sun Kyoung Leea Kwang-Kyun Parka,b Junhee Parka,c
Seung Hwa Sond Mankil Junge Won-Yoon Chunga,b
Кафедра биологии полости рта Научно-исследовательского института рака полости рта, проект BK21 PLUS, Стоматологический колледж Университета Йонсей, Сеул, b Кафедра прикладной биологии, Высшая школа, Университет Йонсей, Сеул, c Кафедра стоматологии, Аспирантура Университета Йонсей, Сеул, d Кафедра стоматологической гигиены, Колледж Гандон, Ичхон, Кафедра химии, Университет Йонсей, Сеул, Корея
Ключевые слова:
Артемизинин • Даумон • Гибридные молекулы • Костные метастазы • Остеолиз, связанный с раком
Аннотация
История вопроса/цели: Костное метастазирование раковых клеток снижает выживаемость и качество жизни пациентов. Гибридизация посредством ковалентного связывания двух биологически активных природных продуктов является полезной стратегией для разработки более мощных противораковых агентов путем повышения их биодоступности и предотвращения резистентности к лекарственным средствам. Методы: Активность in vivo гибрида артемизинин-даумон 15 (ARTD) оценивалась на мышах, инокулированных раковыми клетками, и мышах, подвергнутых овариэктомии. Жизнеспособность, миграция и инвазия раковых клеток измерялись с помощью анализов MTT, заживления ран и инвазии через лунки. Факторы транскрипции, регулируемые ARTD, выявлялись с помощью набора для ПЦР с профилемером RT2 и вестерн-блоттинга. Остеокластогенез и активность остеокластов определялись с помощью окрашивания устойчивой к тартрату кислой фосфатазы, анализа образования лунок, желатиновой зимографии и анализа катепсина К. ELISA. Результаты: ARTD блокировал связанный с раком остеолиз более эффективно, чем артемизинин, у мышей с интрабиально инокулированными клетками рака груди или рака легких. ARTD подавлял жизнеспособность, миграцию и инвазию клеток рака груди и легких в отсутствие или в присутствии трансформирующего фактора роста-β1. Лечение ARTD индуцировало экспрессию опухолевого супрессивного активирующего фактора транскрипции 3 и подавляло экспрессию онкогенного фактора транскрипции E2F на уровнях мРНК и белка. ARTD ингибировал активатор рецептора ядерного фактора каппа-B-лиганд-индуцированное образование остеокластов и активность резорбции костей за счет снижения секретируемых уровней матриксной металлопротеиназы-9 и катепсина К. Кроме того, ARTD предотвращал вызванную дефицитом эстрогена потерю костной массы у мышей с удаленными яичниками. Выводы: ARTD может быть многообещающим кандидатом для ингибирования разрушения костей, вызванного раком. Применение АРТД может быть распространено на пациентов с недостаточностью функции яичников, вызванной химиотерапией, или с постменопаузальным остеопорозом.
Введение
После легких и печени кость является третьим по частоте случаем метастазирования [1]. Большинство метастазов в кости – это рак груди и простаты, но рак легких также часто метастазирует в кости [2]. Частота костных метастазов у пациентов с запущенной стадией рака составляет более 75% по раку груди и простаты и 26-50% по раку легких. Средняя выживаемость после диагностики метастазов в кости составляет 20 месяцев для рака груди, 12-53 месяцев для рака простаты и 6 месяцев для немелкоклеточного рака легкого (НМРЛ) [3]. Костные метастазы не поддаются лечению и вызывают осложнения, включая гиперкальциемию от умеренной до тяжелой, патологические переломы длинных и бедренных костей, компрессию нерва из-за эпидурального распространения опухоли в позвоночник, а также боль в костях [4]. В настоящее время бисфосфонаты (аналоги пирофосфата) и деносумаб (человеческое моноклональное антитело против активатора рецептора ядерного фактора лиганда каппа-B (RANKL)) используются в клинической практике в качестве стандарта лечения разрушения костей, вызванного раком. Однако длительная терапия этими агентами, направленными на кости, вызывает побочные эффекты, включая тяжелую нефротоксичность, остеонекроз челюсти и атипичные переломы бедренной кости [5, 6]. Следовательно, для повышения выживаемости и качества жизни онкологических больных необходимы новые и улучшенные лекарственные препараты, а также вмешательства со значительным воздействием на метастазы в скелете.
Артемизинин (рис. 1A) представляет собой необычный сесквитерпеновый лактон с 1,2,4-триоксановой кольцевой системой, который содержится в китайском лекарственном растении Artemisia annua, а артемизинин и его полусинтетические производные используются в сочетании с другими лекарствами для лечения малярии. вызвано лекарственно-устойчивыми штаммами Plasmodium falciparum [7]. Кроме того, артемизинин и его производные привлекли внимание как многообещающие химиотерапевтические препараты-кандидаты, поскольку они обладают мощной противоопухолевой активностью, которая действует посредством множества молекулярных механизмов как в чувствительных к лекарствам, так и в устойчивых к лекарствам линиях раковых клеток [8-11]. Эти экспериментальные данные демонстрируют большой потенциал соединений артемизинина для использования в качестве терапевтической альтернативы для лечения высокоагрессивных видов рака и для использования в качестве части противоопухолевой комбинированной терапии, не вызывая лекарственной устойчивости или дополнительных побочных эффектов. Однако клиническое применение артемизинина ограничено его кратким периодом полувыведения, плохой биодоступностью и низкой растворимостью [9].
Гибридные молекулы – это комбинации двух или более лекарственных средств, имеющих разную активность и механизмы; Эти комбинации улучшают эффективность лекарственных средств, увеличивая их биодоступность и проход через мембраны клеточных органелл, а также избегая лекарственной устойчивости [12, 13]. Таким образом, гибридизация посредством ковалентного связывания двух биологически активных природных продуктов считается полезной стратегией для разработки более мощных противораковых агентов [14-16]. В недавних исследованиях была сделана попытка синтезировать гибридные молекулы артемизинина с различными химическими структурами [17-20]. Ранее мы синтезировали новые гибридные соединения с использованием артемизинина и гликолипида даумона и обнаружили, что многие гибриды были более цитотоксичными для линий раковых клеток человека, чем лечение только артемизинином или даумоном [21]. Даумон (рис. 1А), феромон, выделенный из Caenorhabditis elegans, классифицируется как гликолипид [22]. Гликолипиды действуют как естественные биосурфактанты с низкой токсичностью или без нее; они также являются биоразлагаемыми, обладают высокой стабильностью в экстремальных условиях pH, солености и температуры, а также повышают растворимость и подвижность углеводородов [23]. Следовательно, гликолипиды могут применяться в косметике, пищевых добавках и биомедицине.
В настоящем исследовании для определения терапевтического потенциала гибрида артемизинин-даумон 15 (ARTD; рис. 1A) в отношении метастазов рака груди и легких в кости, мы исследовали его ингибирующее действие на индуцированный раком остеолиз на мышиной интратибиальной модели, на метастатические способности клеток рака молочной железы MDA-MB-231 и рака легких A549 на индуцированный RANKL остеокластогенез в предшественниках остеокластов и на резорбтивную активность зрелых остеокластов по отношению к кости. Мы также идентифицировали факторы транскрипции, нацеленные на ARTD, в обоих типах раковых клеток. Наконец, мы исследовали влияние ARTD на потерю костной массы, вызванную дефицитом эстрогена, у мышей после овариэктомии.
Материалы и методы
Реагенты
Артемизинин был приобретен в LKT Laboratories (Сент-Пол, Миннесота), а ARTD был предоставлен профессором Манкилом Юнгом [21]. Минимальная основная среда-альфа (α-MEM), среда RPMI 1640, DMEM/питательная смесь F-12 (DMEM/ F-12) без фенолового красного, фосфатно-солевой буферный раствор Дульбекко, HBSS, FBS и смеси антибиотик-антимикотик были приобретены у Gibco BRL (Гранд-Айленд, Нью-Йорк). TGF-β1 был приобретен у Peprotech (Лондон, Англия). Histopaque-1083, 3- (4,5-диметилтиазол-2-ил) -2, 5-дифенилтетразолий бромид (МТТ) и 17β-эстрадиол (E2) были приобретены у Sigma-Aldrich (Сент-Луис, Миссури). Рекомбинантный мышиный растворимый RANKL (sRANKL) и фактор, стимулирующий колонии макрофагов (M-CSF), были приобретены у R&D Systems (Миннеаполис, Миннесота). Все реагенты, использованные в настоящем исследовании, были аналитической степени чистоты.
Животные
Четырехнедельные самцы мышей ICR и 5-недельные самки гбестимусных мышей BALB/c были получены от NARA Biotech (Сеул, Корея). Восьминедельные самки ложных и подвергнутых овариэктомии (OVX) мышей ICR были приобретены у Central Lab Animal (Сеул, Корея). Все исследования на животных проводились в соответствии с экспериментальными протоколами, одобренными Институциональным комитетом по уходу за животными и их использованию стоматологического колледжа Университета Йонсей (номера утверждения IACUC 2012-0324, 2015-0228 и 2015-0261). Все методы были выполнены в согласно соответствующим инструкциям и правилам.
Интратибиальная модель костного разрушения, вызванного раком
Пятинедельных самок бестимусных мышей BALB/c анестезировали смесью золетила 30 мг/кг (Virbac Laboratories, Каррос, Франция) и 10 мг/кг ромпуна (Byer Korea, Сеул, Корея). Клетки MDA-MB-231 или A549 (1 × 106 клеток/50 мкл HBSS) вводили в костный мозг правой большеберцовой кости мышей с помощью шприца Гамильтона со стерильной иглой 27-го размера. Контрольные мыши получали только HBSS вместо раковых клеток. Мышам, которым инъецировали клетки MDA-MB-231 (n = 8), вводили носитель (PBS, содержащий 1% ДМСО и 1% Твин-80), ARTD (10 или 20 мг/кг) или артемизинин (20 мг/кг). через желудочный зонд 5 раз в неделю и золедроновую кислоту (0,1 мг/кг) подкожно 3 раза в неделю. Мышам, которым инъецировали клетки A549 (n = 5) вводили носитель, ARTD (10 или 20 мг/кг) или гефитиниб (10 мг/кг) через желудочный зонд 5 раз в неделю. Через 6 недель были выполнены анализы с помощью микрокомпьютерной томографии (μCT) и гистологические исследования, как описано ранее, а также были изменены маркеры метаболизма костей в сыворотке крови, как описано ранее [24, 25]. Двумерные (2D) и 3D изображения были созданы с использованием программного обеспечения NRecon (SkyScan, Aartselaar, Бельгия). Были проанализированы морфометрические параметры кости, включая объем кости/объем ткани (BV/TV), толщину трабекул (Tb.Th), число трабекул (Tb.N), разделение трабекул (Tb.Sp) и индекс модели структуры (SMI). с помощью программного обеспечения CTAn (Skyscan). Окрашивание гематоксилин-эозином (H&E) и тартрат-устойчивой кислой фосфатазой (TRAP) также выполняли на срезах задних конечностей мыши. Значения площади опухоли и поверхности остеокластов на поверхность кости (Oc.S/BS) измерялись с помощью программного обеспечения IMT i-Solution (версия 7.3, IMT i-Solution, Британская Колумбия, Канада). Площадь опухоли рассчитывалась как процент от общей площади опухоли на площадь ткани. Значения Oc.S/BS определялись как процент поверхности кости, контактирующей с остеокластами. Уровни кальция в сыворотке определялись с помощью набора QuantiChrome Calcium assay kit (BioAssay Systems, Hayward, CA), а уровни TRAP 5b и С-концевого перекрестно связывающего телопептида коллагена типа I (CTX) измерялись с помощью набора для анализа мыши TRAP (Immuno Diagnostic Systems, Boldon, UK) и набор для иммуноферментного анализа RatLaps (Immuno Diagnostic Systems), соответственно.
Клеточные линии и клеточная культура
MDA-MB-231 метастатический рак груди человека и клетки рака легких человека A549 (Корейский банк клеточных линий, Сеул, Корея) выращивали в среде DMEM и RPMI 1640 соответственно, содержащей 10% FBS и 1% смесь антибиотик-антимикотик при 37 °. C с 5% CO2. Макрофаги, полученные из костного мозга мыши (BMM), выделяли из большеберцовых костей самцов мышей ICR в возрасте 4 недель с помощью центрифугирования в градиенте плотности гистопака и культивировали в α-MEM, содержащем 10% FBS, M-CSF (30 нг / мл) и 1% смесь антибиотиков и антимикотиков при 37 ° C с 5% CO2.
Анализ жизнеспособности клеток
Клетки MDA-MB-231 (5 x 103 клеток / лунка) или A549 (1 x 104 клеток/лунка) высевали в 96-луночные планшеты (SPL, Pocheon-Si, Корея) и обрабатывали артемизинином или ARTD в указанных концентрациях. в бессывороточной среде в течение 24, 48 и 72 часов. BMM (5 × 104 клеток/лунка) в 96-луночных планшетах обрабатывали артемизинином или ARTD в указанных концентрациях в присутствии M-CSF (30 нг / мл) в течение 5 дней. Питательную среду заменяли свежей через день. Жизнеспособность клеток определяли с помощью МТТ-анализа.
Анализ направленной миграции клеток
Клетки MDA-MB-231 (2 × 105 клеток/лунка) или A549 (5 × 105 клеток/лунка) высевали в 6-луночные планшеты и инкубировали в среде DMEM и RPMI 1640, соответственно, с 10% FBS. Когда клетки достигли 95% слияния, клеточные монослои царапали узким концом стерильного наконечника микропипетки. Отделившиеся клетки удаляли и сразу же фотографировали область раны в каждой лунке с помощью камеры, подключенной к микроскопу. Клетки инкубировали в среде, содержащей 1% FBS (для клеток MDA-MB-231) или 2% FBS (для клеток A549), 1 мкг/мл митомицина C и указанную концентрацию артемизинина или ARTD в отсутствие или в присутствии TGF-β1 (10 нг/мл). Через 24 часа фотографировали каждую область раны. Ширину области раны измеряли с помощью программного обеспечения ImageJ, а процент закрытия раны определяли по следующей формуле, как описано ранее: [1 - (конечная ширина раны/начальная ширина раны)] x 100 [26].
Анализ клеточного проникновения
Анализы инвазии клеток проводились с использованием камер Transwell (Corning Costar, Кембридж, Массачусетс), как описано ранее [26]. Нижняя часть вставки фильтра из поликарбоната была покрыта желатином (1 мг/мл), а верхняя часть была покрыта матригелем (1 мг/мл; BD Biosciences, Пало-Альто, Калифорния). MDA-MB-231 (5 x 104 клеток/100 мкл) или A549 (1 x 105 клеток/100 мкл) клеток, указанные концентрации артемизинина или ARTD и TGF-β1 (10 нг/мл для MDA-MB-231 клеток или 20 нг/мл для клеток A549) добавляли во вставку каждого трансвела, покрытого матригелем. Нижняя камера содержала 600 мкл культуральной среды с 1% FBS (для клеток MDA-MB-231) или 5% FBS (для клеток A549) в качестве хемоаттрактанта. Камеры системы Трансвел инкубировались в течение 24 часов (для клеток MDA-MB-231) или 48 часов (для клеток A549) при 37 °C. Затем клетки фиксировали 70% метанолом, а мембраны окрашивали гематоксилином. Неповрежденные клетки на верхней поверхности вставки соскребались ватными тампонами, а клетки, которые проникли в желатиновую мембрану на нижней поверхности, помещались на предметные стекла. Окрашенные клетки подсчитывали с помощью микроскопа Zeiss Axio Imager (Carl Zeiss, Геттинген, Германия).
ПЦР-матрица факторов транскрипции человека
Тотальную РНК выделяли из клеток MDA-MB-231 или A549, обработанных ARTD (5 мМ), с использованием мини-набора RNeasy (Qiagen, Валенсия, Калифорния). Затем РНК (2 мкг) превращали в кДНК с использованием набора первой цепи RT2 (Sabioscience, Frederick, MD). кДНК смешивали с RT2 SYBR Green ROX qPCR Master Mix (Sabioscience), и эту смесь вносили аликвотами в лунки планшета для ПЦР с профилемером RT2 (PAHS-075ZA, Human Transcription Factor, Sabioscience). Количественная ПЦР в реальном времени и анализ данных проводили, как описано ранее [24]. Экспрессия мРНК каждого гена была нормализована к экспрессии следующих генов домашнего хозяйства: GAPDH, бета 2-микроглобулина, гипоксантинфосфорибозилтрансферазы 1, рибосомного белка L13a и бета-актина. Изменения уровней экспрессии генов в клетках MDA-MB-231 или A549, обработанных ARTD, выражали как кратное изменение с использованием сравнительного метода ΔCt.
Данные микроматричного анализа рака с использованием общедоступной базы данных Oncomine
База данных Oncomine (http://www.oncomine.org) использовалась для анализа уровней экспрессии генов факторов транскрипции, активирующих фактор транскрипции 3 (ATF3), фактор транскрипции 1 E2F (E2F1) и ядерный фактор гепатоцитов 4 альфа (HNF4a). ) в тканях рака груди и легких по сравнению с таковыми в нормальных тканях. Oncomine независимо обрабатывает и нормализует каждый набор данных, используемый для этого анализа http://www.oncomine.org
Вестерн-блоттинг
Клетки MDA-MB-231 и A549 (1 × 106 клеток/чашка 60 мм) обрабатывали артемизинином или ARTD в указанных концентрациях в течение 24 часов. Лизаты клеток получали с использованием буфера RIPA (Thermo Scientific, Rockford, IL), содержащего коктейль ингибиторов протеаз (Roche Diagnostics, Penzberg, Германия). Лизаты центрифугировали при 22000 x g в течение 15 минут при 4 ° C. Уровни белка в супернатантах измеряли с использованием реагентов для анализа бицинхониновой кислоты (Thermo Scientific). Белки (30 мкг) разделяли на 10% додецилсульфат-полиакриламидном геле и переносили электропереносом на поливинилидендифторидную мембрану (Millipore, Danvers, MA). Мембрану блокировали 5% обезжиренным молоком в трис-буферном физиологическом растворе (150 мМ NaCl, 10 мМ Трис, pH 8,0) с 0,1% (масса/объем) Твин 20, а затем инкубировали с первичными антителами против ATF3 (номер по каталогу sc-188. ), E2F1 (номер по каталогу sc-251), HNF4a (номер по каталогу sc-374229) или GAPDH (номер по каталогу sc-32233) (Santa Cruz Biotechnology, Санта-Крус, Калифорния) с последующей инкубацией с вторичными антителами, конъюгированными с пероксидом хрена. за 1 ч. Целевые белки визуализировались с помощью реагентов для обнаружения вестерн-блоттинга Amersham ECL (GE Healthcare, Бакингемшир, Великобритания) и количественно измерялись с помощью плотномера изображения (ImageMaster VDS CI, Amersham Biosciences Europe, IT).
Анализ образования остеокластов
BMM засевали с плотностью 5 x 104 клеток/лунка в 96-луночные планшеты с α-MEM, содержащим 10% FBS, и обрабатывали артемизинином или ARTD в указанных концентрациях в присутствии M-CSF (30 нг/мл) и sRANKL (100 нг / мл) в течение 5 дней. Питательную среду заменяли свежей через день. Клетки фиксировали 3,7% формальдегидом в течение 1 мин и окрашивали с использованием набора Acid Phosphatase Leukocyte Kit (Sigma-Aldrich). Число остеокластов определяли путем подсчета многоядерных (≥3 ядер) TRAP-положительных клеток с использованием светового микроскопа (исходное увеличение, х40).
Анализ образования лунок
BMM засевали с плотностью 5 x 104 клеток/лунка в планшеты Osteo Assay Stripwell (Corning Costar, Кембридж, Массачусетс) и культивировали в α-MEM, содержащем 10% FBS, в присутствии M-CSF (30 нг/мл) и sRANKL (100 нг/мл) в течение 5 дней. Затем BMM обрабатывали артемизинином или ARTD в указанных концентрациях в присутствии M-CSF (30 нг/мл) и sRANKL (100 нг/мл) в течение дополнительных 8 дней. Среду заменяли каждый второй день и собирали для желатиновой зимографии и анализа катепсина К. BMM на планшете лизировали 5% раствором гипохлорита натрия. Изображения поглощенных лунок получали с помощью светового микроскопа (исходное увеличение х100).
Желатиновая зимография и анализ катепсина К
Концентрацию белка в собранной среде определяли с использованием набора для анализа белка Pierce BCA Protein Assay Kit (Thermo Scientific). Белки (30 мкг) разделяли на 8% полиакриламидном геле додецилсульфата натрия, содержащем 0,2% (масса/объем) желатина. После электрофореза гель дважды промывали 2,5% Triton X-100 в течение 1 ч при комнатной температуре и инкубировали в буфере, содержащем 50 мМ Tris-HCl (pH 7,4), 0,02% NaN3, 10 мМ CaCl2 и 150 мМ NaCl в течение 24 ч при 37 °C. Гель окрашивали раствором 0,1% кумасси бриллиантового синего R-250 (Fluka Chemie, AG, NeuUlm, Швейцария). Четкие зоны на синем фоне указывают на желатинолитическую активность ММП. Уровни катепсина К в культуральной среде определяли с использованием набора для анализа активности катепсина К SensiZyme (Sigma-Aldrich) в соответствии с инструкциями производителя [26].
Животная модель потери костной массы, вызванной овариэктомией
Самок мышей OVX в возрасте восьми недель разделили на 4 группы по 10 мышей, которым вводили несущую среду, ARTD (1 или 5 мг/кг) или E2 (0,1 мг/кг) через желудочный зонд 5 раз в неделю в течение 12 недель. Мыши с ложной операцией получали только несущую среду. Анализы μCT, гистологические исследования и обнаружение маркеров костного метаболизма в сыворотке выполнялись как описано в разделе «Интратибиальная модель разрушения кости, вызванного раком». Уровни щелочной фосфатазы (ЩФ) в сыворотке определяли с помощью набора для анализов QuantiChrome ALP Assay Kit (BioAssay Systems, Хейворд, Калифорния), а уровни остеокальцина измеряли с помощью набора для иммуноферментного анализа остеокальцина (Biomedical Technologies, Stoughton, MA). Уровни TNF-α и IL-1β определяли количественно с использованием их соответствующих коммерчески доступных наборов для ELISA (R&D Systems).
Статистический анализ
Данные выражены как среднее значение ± стандартная ошибка среднего из трех независимых экспериментов. Статистический анализ проводился с использованием одностороннего дисперсионного анализа (ANOVA) и критерия Тьюки для определения различий между двумя группами. Статистически значимыми считались результаты с P < 0,05. Статистический анализ выполнен с использованием программного обеспечения SPSS версия 20.0 (SPSS, Чикаго, Иллинойс).
Результаты
Ингибирующее действие ARTD на вызванное раковыми клетками разрушение костей у мышей
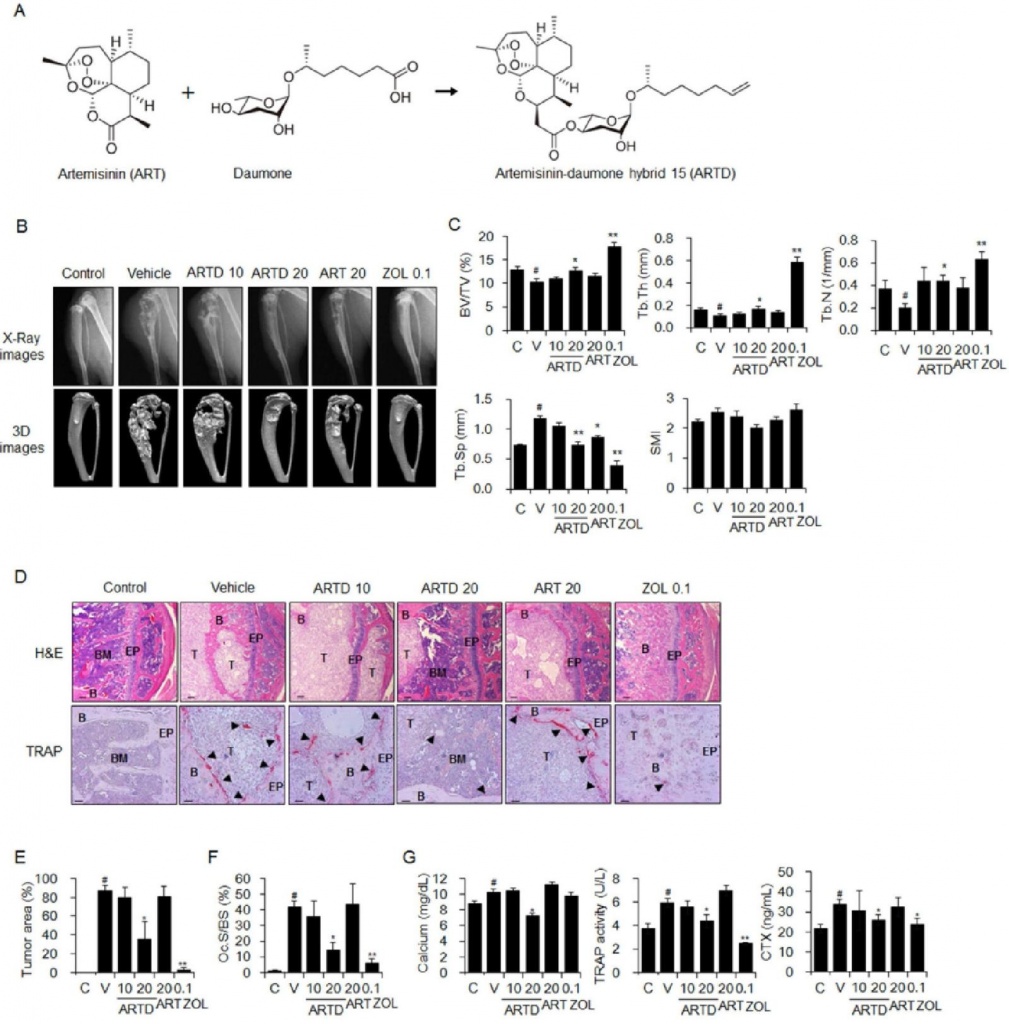
Ингибирующее действие ARTD in vivo на остеолиз, опосредованный раковыми клетками, было впервые исследовано на мышах, которым интратибиально инъецировали клетки рака груди или рака легких, которые чаще всего ответственны за метастатические заболевания костей. Пероральное введение ARTD в течение 6 недель дозозависимо блокировало индукцию тяжелых остеолитических поражений в большеберцовых костях мышей, которым инъецировали клетки MDA-MB-231, как показано на рентгеновских и трехмерных изображениях, полученных в результате анализа mCT (рис. 1B). В частности, лечение ARTD в дозе 20 мг/кг восстанавливало пониженные значения BV/TV, Tb.Th и Tb.N и притупляло повышенные значения Tb.Sp и SMI по сравнению с контрольными значениями у мышей, получавших носитель (рис. 1C). ). Окрашивание H&E и TRAP показало, что лечение ARTD подавляло рост клеток рака молочной железы MDA-MB-231 в костном мозге большеберцовых костей мыши (рис. 1D и E) и образование TRAP-положительных остеокластов на поверхностях костей вблизи опухоли. масс (рис. 1D и F). Уровни кальция в сыворотке крови, TRAP5b
и CTX, которые были повышены после инокуляции клеток MDA-MB-231, также ингибировались лечением ARTD (рис. 1G). Лечение ARTD в дозе 20 мг/кг подавляло рост опухоли и образование остеолитических поражений сильнее, чем лечение артемизинином в той же дозе, но пероральное введение ARTD в дозе 20 мг/кг было не более эффективным, чем вводимая подкожно золедроновая кислота в дозе 0,1 мг/кг. ARTD и артемизинин в введенных дозах не влияли на сывороточные уровни аланинаминотрансферазы (ALT) или аспартатаминотрансферазы (AST), которые являются индикаторами гепатотоксичности, или уровни азота мочевины в сыворотке крови (BUN) или креатинина, которые являются индикаторами нефротоксичности Рис. S1A –Все дополнительные материалы см. на сайте www.karger.com/10.1159/000493449 /).http://www.karger.com/
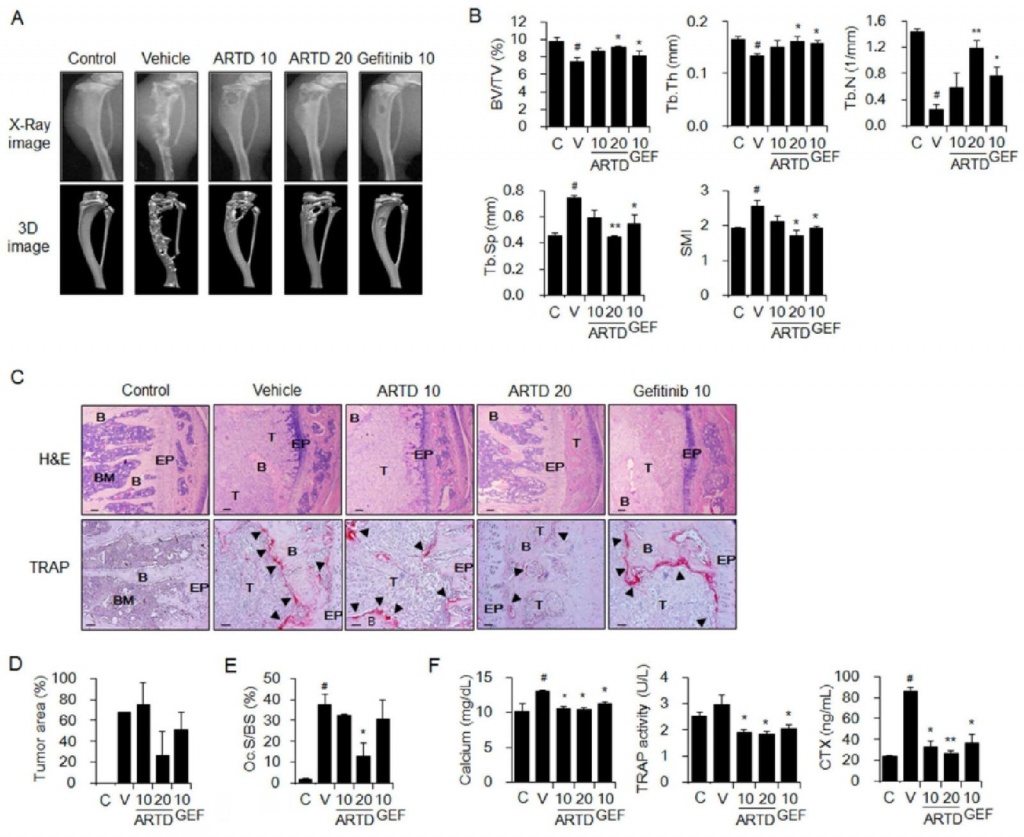
У мышей, инокулированных клетками NSCLC A549, пероральное введение ARTD также уменьшало образование остеолитических поражений дозозависимым образом, как показано на рентгеновских и трехмерных изображениях (рис. 2A), анализе морфометрических параметров кости (рис. 2B), окраске гематоксилин-эозином и тартрату кислой фосфатазой (TRAP) (рис. 2C), область опухоли в костном мозге (рис. 2D), образование остеокластов на границе опухоль-кость (рис. 2E) и сывороточные уровни маркеров метаболизма кости (фиг. 2F). ARTD в дозе 20 мг/кг был так же эффективен, как и гефитиниб в дозе 10 мг/кг. Повреждение тканей печени и почек не наблюдалось у мышей, инокулированных клетками A549, которым перорально вводили ARTD (рис. S1B).
Подавляющее действие ARTD на метастатическую способность клеток рака груди и легких
Мы исследовали, может ли лечение ARTD значительно подавить жизнеспособность, миграцию и инвазию раковых клеток. ARTD в более низких концентрациях в зависимости от дозы и времени снижал жизнеспособность MDA-MB-231 рака молочной железы (рис. 3A) и клеток NSCLC A549 (рис. 3B), тогда как лечение артемизинином до 80 мМ не показало заметной цитотоксической активности. . Обработка ARTD и артемизинином в нецитотоксических концентрациях в течение 24 часов подавляла миграцию клеток MDA-MB-231 (рис. 3C) и A549 (рис. 3D) в отсутствие или в присутствии TGF-b. Обработка 20 мкМ артемизинина и 2,5 мкМ ARTD ингибировала миграцию клеток MDA-MB-231 на 11% и 19% соответственно, а клеток A549 - на 17% и 38% соответственно. Обработка 20 мкМ артемизинина и 2,5 мкМ ARTD ингибировала миграцию стимулированных TGF-b клеток MDA-MB-231 на 25% и 30%, соответственно, и миграцию стимулированных TGF-b клеток A549 на 19% и 40%. соответственно. Кроме того, лечение ARTD и артемизинином в нецитотоксических концентрациях в течение 24 часов эффективно ингибировало инвазию клеток MDA-MB-231 (рис. 3E) и A549 (рис. 3F) в отсутствие или в присутствии TGF-b. В клетках MDA-MB-231 20 мкМ артемизинина и 2,5 мкМ ARTD ингибировали клеточную инвазию на 36% и 53%, соответственно, и индуцированную TGF-β инвазию на 43% и 63%, соответственно. В клетках A549 20 мкМ артемизинина и 2,5 мкМ ARTD ингибировали клеточную инвазию на 76% и 85% и индуцированную TGF-β инвазию на 30% и 70% соответственно.
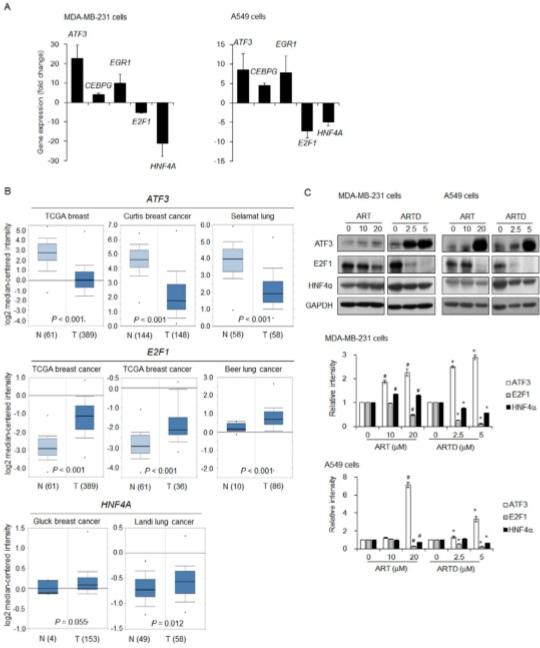
Факторы транскрипции, нацеленные на ARTD в клетках MDA-MB-231 и A549, и корреляция между уровнями экспрессии их генов и раком груди или легких
Чтобы идентифицировать молекулы-мишени, тесно связанные с антиметастатическим действием ARTD, мы использовали наборы ПЦР для изучения измененной экспрессии факторов транскрипции человека в клетках MDA-MB-231 и A549, подвергшихся воздействию ARTD. Лечение ARTD привело к усилению мРНК ATF3 и подавлению мРНК E2F1 и HNF4A как в клетках MDA-MB-231 (рис. 4A и таблица S1), так и в клетках A549 (рис. 4A и таблица S2). Уровни мРНК CCAAT/связывающего белка энхансера гамма (CEBPG) и реакции раннего роста 1 (EGR1) также были повышены, но повышение не было значительным. Клиническая важность этих факторов транскрипции была проанализирована с использованием данных микрочипов пациентов с раком груди и легких из базы данных Oncomine. Уровни экспрессии ATF3 были значительно снижены, а уровни экспрессии гена E2F1 были повышены в тканях пациентов с раком груди и легких по сравнению с таковыми в нераковых тканях. Значительно повышенная экспрессия гена HNF4a наблюдалась в тканях рака легких (рис. 4B). Согласно анализу вестерн-блоттинга, лечение артемизинином и ARTD индуцировало экспрессию белка ATF3 и снижало экспрессию белка E2F1 в клетках MDA-MB-231 и A549. Уровни экспрессии HNF4a ингибировались обработкой ARTD в клетках MDA-MB-231 и A549, но обработка артемизинином в более высоких концентрациях подавляла уровни экспрессии этих белков в клетках A549 (рис. 4C).
Рис. 1 Подавляющее действие ARTD на остеолиз, вызванный раком груди у мышей. Клетки MDA-MB-231 вводили мышам в костный мозг правой большеберцовой кости. Контрольные мыши получали только HBSS. Мышам, которым инъецировали клетки MDA-MB-231 (n = 8), вводили носитель (PBS, содержащий 1% ДМСО и 1% Твин-80), ARTD (10 и 20 мг/кг) или артемизинин (ART, 20 мг/кг) через желудочный зонд 5 раз в неделю и золедроновой кислоты (ZOL, 0,1 мг/кг) подкожно 3 раза в неделю в течение 6 недель. (A) Химические структуры артемизинина, даумона и ARTD. (B) Рентгенографические и 3D-изображения голеней мышей, полученные в результате сканирования mCT. (C) Костные морфометрические параметры большеберцовых костей, полученные на основе анализа mCT. (D) Окрашивание тканей большеберцовой кости H&E и TRAP. Стрелки: TRAP-положительные остеокласты; Т: опухоль; B: кость; BM: костный мозг; ЭП: эпифизарная пластинка. Масштабная линейка: 0,246 мм для окраски гематоксилин-эозином и 10 мм для окраски устойчивой к тартрату кислой фосфатазой (TRAP). (E) площади опухоли и (F) значения площади остеокластов на поверхность кости (Oc.S/BS) для окрашенных срезов большеберцовой кости. (G) Сывороточные уровни маркеров резорбции кости, кальция, TRAP5b и CTX. Данные выражены как среднее значение ± стандартная ошибка среднего. #P < 0,05 по сравнению с контрольными (C) мышами,* P < 0,05; ** P < 0,01 по сравнению с мышами, получавшими носитель (V).
Подавляющее действие ARTD на образование и активность остеокластов
Мы определили концентрации артемизинина и ARTD, которые не были цитотоксичны для BMM, путем исследования жизнеспособности BMM, обработанных артемизинином и ARTD в присутствии M-CSF в течение 5 дней. Артемизинин не снижает жизнеспособность BMM до 80 мкМ. ARTD подавлял жизнеспособность клеток на 73% при концентрации 1 мМ, но не влиял на жизнеспособность клеток при концентрации менее 0,5 мМ (рис. S2). Когда костный мозг мыши (BMM) проходил лечение артемизинином и ARTD в
Рис. 2. Ингибирующее действие ARTD на остеолиз, вызванный NSCLC, у мышей. Клетки A549 вводили мышам в костный мозг правой большеберцовой кости. Контрольные мыши получали только HBSS. Мышам, которым инъецировали клетки A549 (n = 5), вводили носитель (PBS, содержащий 1% ДМСО и 1% Твин-80), ARTD (10 или 20 мг/кг) или гефитиниб (GEF, 10 мг/кг) перорально. желудочный зонд 5 раз в неделю в течение 6 недель. (A) Рентгенографические и 3D-изображения, полученные на основе МКТ-сканирования. (B) Костные морфометрические параметры большеберцовых костей, полученные на основе анализа mCT. (C) H&E и TRAP окрашивание тканей большеберцовой кости. Стрелки: TRAP-положительные остеокласты; Т: опухоль; B: кость; BM: костный мозг; ЭП: эпифизарная пластинка. Шкала: 0,246 мм для окрашивания H&E и 10 мм для окрашивания TRAP. (D) площади опухолей и (E) значения площади остеокластов на поверхность кости (Oc.S/BS) для окрашенных срезов большеберцовой кости. (F) Сывороточные уровни маркеров резорбции кости. Данные выражены как среднее значение ± стандартная ошибка среднего. #P < 0,05 по сравнению с контрольными (C) мышами, * P <0,05; ** P < 0,01 по сравнению с мышами, получавшими носитель (V).
нецитотоксические концентрации в присутствии M-CSF и RANKL в течение 5 дней, RANKL-индуцированный остеокластогенез блокировался дозозависимым образом. Обработка 5 мМ артемизинином и 0,3 мМ ARTD ингибировала образование остеокластов более чем на 90% (рис. 5A). Когда BMM обрабатывали артемизинином и ARTD после дифференциации предшественников остеокластов в зрелые остеокласты, ARTD предотвращал образование резорбтивных ямок на пластинах, покрытых фосфатом кальция (рис. 5B). После обработки RANKL уровни про- и активного MMP-9 (рис. 5C) и активность катепсина K (рис. 5D) были увеличены в культуральной среде дифференцированных остеокластов, но повышенная активность этих протеаз значительно ингибировалась лечением ARTD. Однако артемизинин в более высоких концентрациях, чем ARTD, не уменьшал опосредованное остеокластами образование ямок или активность протеазы.
Ингибирующий эффект ARTD на потерю костной массы, вызванную дефицитом эстрогена
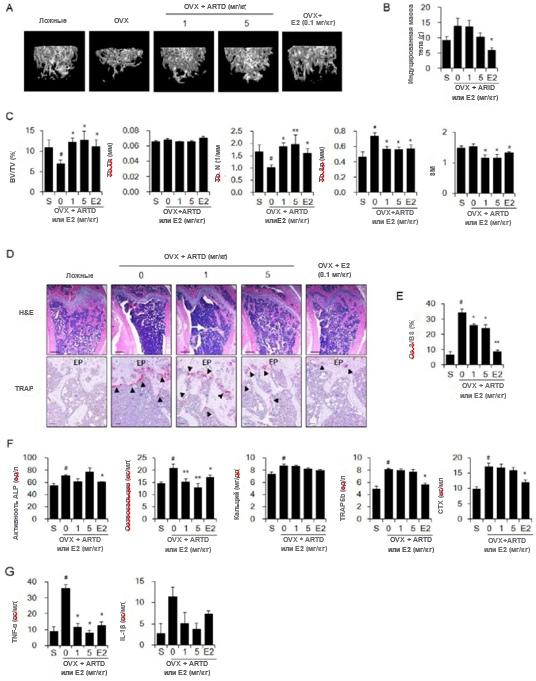
Мы также оценили ингибирующие эффекты ARTD на потерю костной массы у мышей OVX, животной модели остеопороза, вызванного дефицитом эстрогена. На трехмерных изображениях трабекулярных костей бедренной кости, реконструированных с использованием данных μCT, вызванная OVX потеря трабекулярной кости ингибировалась лечением ARTD в зависимости от дозы (рис. 6A). Увеличение веса у мышей OVX составляло
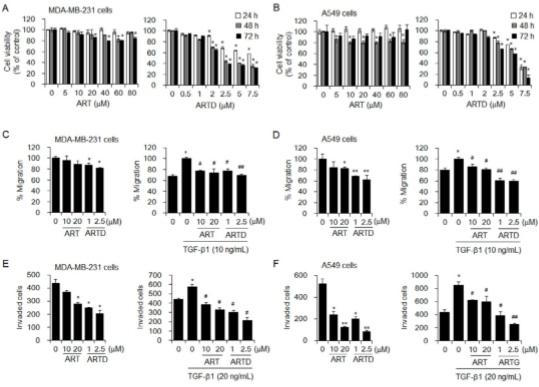
Рис. 3. Ингибирующее действие ARTD на метастатическую способность клеток MDA-MB-231 и A549. (A, B) Жизнеспособность клеток MDA-MB-231 и A549, обработанных артемизинином (ART) и ARTD в указанных концентрациях в течение 24, 48 и 72 часов. Жизнеспособность клеток определяли с помощью МТТ-анализа. (C, D) Миграция и (E, F) инвазия клеток MDA-MB-231 и A549, обработанных указанными концентрациями ART и ARTD в отсутствие или в присутствии TGF-b в течение 24 часов. Миграция клеток указывается как процент закрытия раны через 24 часа по сравнению с таковым через 0 часов. Число пораженных клеток подсчитывали в пяти случайных полях на мембрану. Данные выражены как среднее значение ± стандартная ошибка среднего. * P < 0,05; ** P < 0,01 по сравнению с необработанными клетками, #P < 0,05; ## P < 0,01 по сравнению с клетками, обработанными только TGF-b.
снижается при пероральном введении ARTD в дозе 5 мг/кг (рис. 6B). Пероральное введение ARTD блокировало вызванное OVX снижение значений BV/TV и Tb.N, а также вызванное OVX повышение значений Tb.Sp и SMI (рис. 6C). Окрашивание H&E также показало, что введение ARTD ингибировало потерю костной массы (рис. 6D). Значения окрашивания TRAP и поверхности остеокластов на поверхность кости (Oc.S/BS), полученные из окрашенных срезов бедренной кости, показали, что образование TRAP-положительных остеокластов на поверхностях губчатой кости подавлялось обработкой ARTD (рис. 6D и E). Лечение ARTD значительно снизило уровни остеокальцина в сыворотке у мышей OVX по сравнению с таковыми у фиктивных мышей. Однако лечение ARTD не оказывало значительного подавления индуцированных OVX уровней сывороточной ЩФ, кальция, TRAP 5b или CTX (рис. 6F). Кроме того, лечение мышей OVX с помощью ARTD ингибировало повышение сывороточных уровней TNF-α и IL-1β (рис. 6G).
Обсуждение
Артемизинин с эндопероксидным фрагментом может продуцировать цитотоксические свободные радикалы, вступая в реакцию с клеточным железом. Артемизинин и его аналоги избирательно вызывают апоптоз раковых клеток, которые имеют значительно больше внутриклеточного свободного железа, чем нормальные клетки. Эти соединения более безопасны, но менее эффективны, чем традиционные химиотерапевтические агенты, из-за их низкой биодоступности и короткого периода полураспада в плазме крови человека. Следовательно, для клинического применения необходимо разработать более сильные и избирательные по отношению к мишеням соединения артемизинина. В этом исследовании мы определили терапевтический потенциал ARTD для ингибирования разрушения костей, опосредованного раком, и подтвердили, что связывание природного гликолипида даумона с артемизинином может
Рис. 4. Факторы транскрипции, регулируемые ARTD в клетках рака груди и легких. (A) Измененные уровни экспрессии мРНК факторов транскрипции в раковых клетках, обработанных ARTD. ПЦР-массивы профилировщика RT2 для факторов транскрипции человека проводили в клетках MDA-MB-231 или A549, обработанных ARTD (5 мкМ) в течение 24 ч, как описано в разделе «МАТЕРИАЛЫ И МЕТОДЫ». Изменения в экспрессии генов выражаются как кратные изменения по сравнению с уровнями экспрессии генов в необработанных клетках и как среднее значение ± стандартная ошибка среднего. (B) Уровни экспрессии генов факторов транскрипции, регулируемых ARTD, в нормальных и опухолевых тканях. Коробчатые диаграммы были извлечены из базы данных Oncomine. N: нормальная ткань; Т: опухолевая ткань. (C) Экспрессия белков транскрипционных факторов, на которые нацелена ARTD. Клетки MDA-MB-231 или A549 обрабатывали артемизинином (ART) или ARTD в указанных концентрациях в течение 24 часов. Уровни экспрессии белка исследовали с помощью Вестерн-блоттинга. GAPDH служил контролем загрузки.
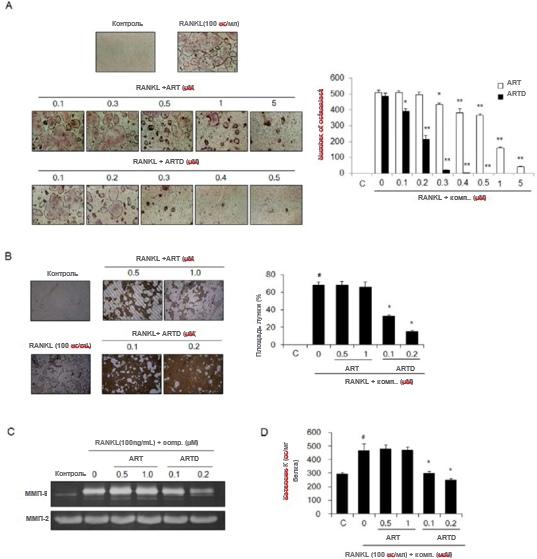
Рис. 5. Антиостеокластогенная и противорезорбтивная активность ARTD. (А) Образование остеокластов. BMM инкубировали в α-MEM с M-CSF, RANKL и указанными концентрациями артемизинина (ART) или ARTD в течение 5 дней. TRAP-положительные многоядерные клетки (≥ 3 ядер) считали остеокластами. (B-D) После того, как BMM дифференцировались в зрелые остеокласты на планшетах Osteo Assay Surface, клетки обрабатывали указанными концентрациями ART и ARTD в течение дополнительных 8 дней. (B) Резорбция кости. Лунки резорбции наблюдали с помощью светового микроскопа (увеличение × 100), а площадь резорбции рассчитывали с помощью программного обеспечения ImageJ. (C) ММП активность. Активность ММП-2 и ММП-9 в культуральной среде определяли с помощью желатиновой зимографии. (D) Активность катепсина К. Активность катепсина К в культуральной среде определяли с использованием набора для анализа активности катепсина К. SensiZyme. Данные выражены как среднее значение ± стандартная ошибка среднего. #P < 0,05 по сравнению с контролем (C), * P < 0,05 по сравнению с BMM, обработанными только RANKL.
значительно улучшают противоопухолевую и противорезорбтивную активность артемизинина.
Несмотря на множество различий между раком груди и рака легких, включая их причины и уровень смертности, метастазы в кости при раке груди и распространенным немелкоклеточным раком легкого (NSCLC) классифицируются как остеолитические. Образование тяжелых остеолитических повреждений метастазами в кости вызвано усилением взаимодействий между опухолевыми клетками, остеобластическими/стромальными клетками и остеокластическими клетками. Опухолевые клетки выделяют несколько цитокинов, включая интерлейкин (IL) -1b, IL-6 и белок, связанный с паратироидным гормоном. Эти высвобождаемые цитокины стимулируют экспрессию RANKL в остеобластах.
Рис. 6. Подавляющее действие ARTD на потерю костной массы, связанную с дефицитом эстрогена, у мышей OVX. Самкам мышей OVX в возрасте восьми недель (n = 10) вводили носитель, ARTD (1 или 5 мг/кг) или E2 (0,1 мг/кг) через желудочный зонд 5 раз в неделю в течение 12 недель. Мыши с ложной операцией (n = 10) получали только транспортное средство. (A) Трехмерные изображения трабекулярных костей дистальных отделов бедра мыши, полученные с помощью сканирования с помощью μCT. (B) Масса тела, измеренная на 12-й неделе. (C) Морфометрические параметры костей бедра мыши. (D) Окрашивание тканей бедренной кости H&E и TRAP. Указатели: TRAP-положительные остеокласты; ЭП: эпифизарная пластинка. Масштабная линейка: 0,246 мм для окраски гематоксилин-эозином и 10 мм для окраски устойчивой к тартрату кислой фосфатазой (TRAP). (E) Значения площади остеокластов на поверхность кости (Oc.S/BS) для окрашенных срезов бедренной кости. (F) Сывороточные уровни маркеров обновления костной ткани. (G) Сывороточные уровни провоспалительных цитокинов TNF-α и IL-1β. Данные выражены как среднее значение ± стандартная ошибка среднего. #P < 0,01 по сравнению с мышами, подвергшимися ложной операции (S), * P < 0,05; ** P <0,01 по сравнению с мышами OVX.
стромальные клетки, а растворимый и связанный с мембраной RANKL индуцирует дифференцировку остеокластов и последующую резорбцию кости. TGF-β1, полученный из резорбированной кости, способствует росту опухоли и высвобождению цитокинов из опухолевых клеток. Повторные взаимодействия опухолевых клеток с костным микроокружением усугубляют остеолиз [27, 28].
Мы впервые обнаружили, что введение ARTD ингибирует опосредованную раком груди потерю костной массы в большеберцовых костях мышей, инокулированных метастатическим раком груди или клетками NSCLC. Пероральное введение ARTD в дозе 20 мг/кг, очевидно, предотвращало рост раковых клеток и образование остеолитических поражений, не оказывая токсического воздействия на печень и почки, как показано на изображениях МКТ, морфометрических параметрах кости, гистологических исследованиях и маркерах метаболизма в сыворотке. и повреждение тканей. Однако пероральное введение артемизинина в той же дозе не вызывало этих ингибирующих эффектов. Тормозящие эффекты лечения ARTD были не такими сильными, как эффекты, вызванные подкожной инъекцией золедроновой кислоты. Однако ATRD в дозе 20 мг/кг был так же эффективен, как и гефитиниб в дозе 10 мг/кг, который является селективным ингибитором тирозинкиназы рецептора эпидермального фактора роста, клинически применяемым для лечения рака [29].
Ингибирующая активность ARTD in vivo в отношении остеолиза, опосредованного раковыми клетками, была подтверждена в экспериментах на клетках. Лечение ARTD в нецитотоксических концентрациях дозозависимо подавляло жизнеспособность, миграцию и инвазию клеток рака молочной железы MDA-MB-231 и рака легких A549, обработанных TGF-b или нет. Кроме того, мы идентифицировали ATF3, E2F1 и HNF4a как факторы транскрипции, регулируемые ARTD. ATF3, член семейства связывающих элементов ответа ATF/циклического AMP, представляет собой ген адаптивного ответа, который участвует в клеточных процессах адаптации к внеклеточным и внутриклеточным стимулам. Повышенная регуляция ATF3 подавляет миграцию и инвазию в некоторых типах раковых клеток [30-32]; поэтому новые и специфические индукторы ATF3 считаются кандидатами в противораковые препараты. E2F1 транскрипционно регулирует многие биологические функции, которые не регулируются при раке [33, 34]. Недавние исследования показали, что повышенная экспрессия E2F1 вызывает инвазию и метастазирование, активируя сигнальные пути рецепторов роста и способствуя антиапоптотическому микроокружению опухоли [35, 36]. HNF4a, ядерный рецептор, экспрессируемый в эпителиальных клетках печени и кишечника, по-видимому, подавляет хроническое и патологическое воспаление [37] и эпителиально-мезенхимальный переход в гепатоцитах [38]. Напротив, HNF4α был описан как маркер инвазивной муцинозной аденокарциномы легких [39] и для различия между первичной и метастатической карциномой молочной железы и желудка [40].
При анализе с использованием общедоступной базы данных Oncomine уровни мРНК ATF3 были снижены, а уровни E2F1 значительно увеличены в тканях опухоли груди или легких по сравнению с таковыми в нормальных тканях, демонстрируя, что уровни экспрессии генов ATF3 и E2F1 тесно коррелируют с опухолями. Напротив, уровни мРНК HNF4a были увеличены в опухолевых тканях, но имели статистически значимую корреляцию только с тканями рака легких. Лечение ARTD увеличивало уровни мРНК и белка ATF3 и снижало уровни E2F1 и HNF4a как в клетках MDA-MB-231, так и в клетках A549. Эти результаты показывают, что ARTD подавляет злокачественные свойства клеток рака груди и легких, регулируя уровни экспрессии факторов транскрипции, имеющих прогностическое значение, в частности, опухолевого супрессивного ATF3 и онкогенного E2F1. Лечение ARTD привело к значительному ингибированию при гораздо более низких концентрациях, чем лечение артемизинином, и более сильному ингибированию в клетках рака легких A549, чем в клетках рака молочной железы MDA-MB-231.
Активность остеокластов является критическим фактором в порочном круге индуцированного раком остеолитического разрушения кости [27, 28]. Дифференцировка предшественников остеокластов в зрелые остеокласты запускается связыванием RANKL с его рецептором RANK на предшественниках остеокластов [41]. Зрелые остеокласты вызывают серьезную резорбцию кости, секретируя протеазы и протоны [42, 43]. Ингибиторы ММП и катепсина К считаются многообещающими терапевтическими кандидатами для лечения заболеваний, связанных с остеокластами [44, 45]. ARTD в нецитотоксических концентрациях заметно подавлял индуцированное RANKL образование остеокластов, образование ямок, опосредованное зрелыми остеокластами, и секрецию MMP-9 и катепсина K зрелыми остеокластами. Антиостеокластические и противорезорбтивные эффекты костей ARTD в более низких концентрациях были более сильными, чем у артемизинина. Однако лечение артемизинином и ARTD не блокировало повышение уровня RANKL и снижение уровня OPG в остеобластических клетках, стимулированных кондиционированной средой раковых клеток (рис. S3). Эти результаты показывают, что ARTD способствует уменьшению остеолиза, вызванного раком, за счет воздействия на остеокласты.
Мы дополнительно исследовали, может ли АРТ подавлять потерю костной массы, связанную с дефицитом эстрогена. Пероральное введение ARTD подавляло потерю костной массы, вызванную дефицитом эстрогена, путем ингибирования вызванных OVX изменений морфометрических параметров кости и метаболизма костной ткани.
маркеры у мышей. Более того, лечение ARTD снижает продукцию провоспалительных цитокинов TNF-a и IL-b у мышей OVX. TNF-a и IL-b являются провоспалительными цитокинами, которые связаны с резорбцией остеокластической кости путем стимуляции экспрессии RANKL [46, 47]. Применение АРТД может быть распространено на пациентов с вызванной химиотерапией преждевременной недостаточностью яичников или постменопаузальным остеопорозом, аналогично существующим терапевтическим бисфосфонатным агентам.
ARTD подавлял опосредованную раком груди и легких потерю костной массы, подавляя злокачественные свойства раковых клеток посредством нацеливания на опухоль-супрессивный ATF3 и онкогенный E2F1, а также путем блокирования образования и активности остеокластов. Кроме того, ARTD предотвращает потерю костной массы, вызванную дефицитом эстрогена. Гибридизация гликолипида даумона с артемизинином заметно усиливала противоопухолевую и противодействующую резорбции костей артемизинина без заметной токсичности. Следовательно, ARTD может быть полезным средством для предотвращения и лечения потери костной массы, вызванной раком, и его применение может быть распространено на потерю костной массы, вызванную химиотерапией, и потерю костной массы в постменопаузе.
Выражения признательности
Мы благодарим Чэ-Ын Ли из Научно-исследовательского института стоматологии за техническую помощь с μCT. Эта работа проводилась при поддержке «Программы совместных исследований для развития сельскохозяйственных наук и технологий (PJ011578)» Управления по развитию сельских районов Республики Корея.
Заявление о раскрытии информации
Авторы заявляют об отсутствии конфликта интересов.
Библиографический список
► 1 Coleman RE: Metastatic bone disease: clinical features, pathophysiology and treatment strategies. Cancer Treat Rev 2001;27:165-176.
► 2 Yin JJ, Pollock CB, Kelly K: Mechanisms of cancer metastasis to the bone. Cell Res 2005;15:57-62.
► 3 Budczies J, von Winterfeld M, Klauschen F, Bockmayr M, Lennerz JK, Denkert C, Wolf T, Warth A, Dietel M, Anagnostopoulos I, Weichert W, Wittschieber D, Stenzinger A: The landscape of metastatic progression patterns across major human cancers. Oncotarget 2015;6:570-583.
► 4 Nielsen OS, Munro AJ, Tannock IF: Bone metastases: pathophysiology and management policy. J Clin Oncol 1991;9:509-524.
► 5 Coleman RE: Impact of bone-targeted treatments on skeletal morbidity and survival in breast cancer Oncology (Williston Park) 2016;30:695-702.
► 6 Isla D, Afonso R, Bosch-Barrera J, Martinez N: Zoledronic acid in lung cancer with bone metastases: a review. Expert Rev Anticancer Ther 2013;13:421-426.
► 7 Eastman RT, Fidock DA: Artemisinin-based combination therapies: a vital tool in efforts to eliminate malaria. Nat Rev Microbiol 2009;7:864-874.
► 8 Crespo-Ortiz MP, Wei MQ: Antitumor activity of artemisinin and its derivatives: from a well-known antimalarial agent to a potential anticancer drug. J Biomed Biotechnol 2012;2012:247597.
► 9 Das AK: Anticancer Effect of antimalarial artemisinin compounds. Ann Med Health Sci Res 2015;5:93-102.
► 10 Efferth T: Cancer combination therapies with artemisinin-type drugs. Biochem Pharmacol 2017;139:56-70.
► 11 Ho WE, Peh HY, Chan TK, Wong WS: Artemisinins: pharmacological actions beyond anti-malarial. Pharmacol Ther 2014;142:126-139.
► 12 Fortin S, Berube G: Advances in the development of hybrid anticancer drugs. Expert Opin Drug Discov 2013;8:1029-1047.
► 13 Meunier B: Hybrid molecules with a dual mode of action: dream or reality? Acc Chem Res 2008;41:69-77.
►14 Muller-Schiffmann A, Sticht H, Korth C: Hybrid compounds: from simple combinations to nanomachines. BioDrugs 2012;26:21-31.
►15 Sunil D, Kamath PR: Multi-target directed indole based hybrid molecules in cancer therapy : an up-to-date evidence-based review. Curr Top Med Chem 2017;17:959-985.
►16 Teiten MH, Dicato M, Diederich M: Hybrid curcumin compounds: a new strategy for cancer treatment. Molecules 2014;19:20839-20863.
►17 Frohlich T, Ndreshkjana B, Muenzner JK, Reiter C, Hofmeister E, Mederer S, Fatfat M, El-Baba C, Gali- Muhtasib H, Schneider-Stock R, Tsogoeva SB: Synthesis of novel hybrids of thymoquinone and artemisinin with high activity and selectivity against colon cancer. ChemMedChem 2017;12:226-234.
►18 Lai HC, Singh NP, Sasaki T: Development of artemisinin compounds for cancer treatment. Invest New Drugs 2013;31:230-246.
►19 Letis AS, Seo EJ, Nikolaropoulos SS, Efferth T, Giannis A, Fousteris MA: Synthesis and cytotoxic activity of new artemisinin hybrid molecules against human leukemia cells. Bioorg Med Chem 2017;25:3357-3367.
►20 Tian Y, Liang Z, Xu H, Mou Y, Guo C: Design, synthesis and cytotoxicity of novel dihydroartemisinin- coumarin hybrids via click chemistry. Molecules 2016;21.
►21 Ricci J, Kim M, Chung WY, Park KK, Jung M: Discovery of artemisinin-glycolipid hybrids as anti-oral cancer agents. Chem Pharm Bull (Tokyo) 2011;59:1471-1475.
►22 Jeong PY, Jung M, Yim YH, Kim H, Park M, Hong E, Lee W, Kim YH, Kim K, Paik YK: Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature 2005;433:541-545.
►23 Mnif I, Ghribi D: Glycolipid biosurfactants: main properties and potential applications in agriculture and food industry. J Sci Food Agric 2016;96:4310-4320.
►24 Kim HJ, Park J, Lee SK, Kim KR, Park KK, Chung WY: Loss of RUNX3 expression promotes cancer- associated bone destruction by regulating CCL5, CCL19 and CXCL11 in non-small cell lung cancer. J Pathol 2015;237:520-531.
►25 Lee SK, Park KK, Kim HJ, Park J, Son SH, Kim KR, Chung WY: Human antigen R-regulated CCL20 contributes to osteolytic breast cancer bone metastasis. Sci Rep 2017;7:9610.
►26 Kim KR, Kim HJ, Lee SK, Ma GT, Park KK, Chung WY: 15-deoxy-delta12, 14-prostaglandin j2 inhibits osteolytic breast cancer bone metastasis and estrogen deficiency-induced bone loss. PLoS One 2015;10:e0122764.
►27 Al Husaini H, Wheatley-Price P, Clemons M, Shepherd FA: Prevention and management of bone metastases in lung cancer: a review. J Thorac Oncol 2009;4:251-259.
►28 Roodman GD: Mechanisms of bone metastasis. N Engl J Med 2004;350:1655-1664.
►29 D'Incecco A, Cappuzzo F: Gefitinib for non-small-cell lung cancer treatment. Expert Opin Drug Saf 2011;10:987-996.
►30 Bar J, Hasim MS, Baghai T, Niknejad N, Perkins TJ, Stewart DJ, Sekhon HS, Villeneuve PJ, Dimitroulakos J: Induction of activating transcription factor 3 is associated with cisplatin responsiveness in non-small cell lung carcinoma cells. Neoplasia 2016;18:525-535.
►31 Gokulnath M, Partridge NC, Selvamurugan N: Runx2, a target gene for activating transcription factor-3 in human breast cancer cells. Tumour Biol 2015;36:1923-1931.
►32 Patacsil D, Tran AT, Cho YS, Suy S, Saenz F, Malyukova I, Ressom H, Collins SP, Clarke R, Kumar D: Gamma- tocotrienol induced apoptosis is associated with unfolded protein response in human breast cancer cells. J Nutr Biochem 2012;23:93-100.
►33 Engelmann D, Putzer BM: The dark side of E2F1: in transit beyond apoptosis. Cancer Res 2012;72:571-575.
►34 Meng P, Ghosh R: Transcription addiction: can we garner the Yin and Yang functions of E2F1 for cancer therapy? Cell Death Dis 2014;5:e1360.
►35 Abdraboh ME, Gaur RL, Hollenbach AD, Sandquist D, Raj MH, Ouhtit A: Survivin is a novel target of CD44- promoted breast tumor invasion. Am J Pathol 2011;179:555-563.
►36 Pillai S, Trevino J, Rawal B, Singh S, Kovacs M, Li X, Schell M, Haura E, Bepler G, Chellappan S: beta- arrestin-1 mediates nicotine-induced metastasis through E2F1 target genes that modulate epithelial- mesenchymal transition. Cancer Res 2015;75:1009-1020.
►37 Babeu JP, Boudreau F: Hepatocyte nuclear factor 4-alpha involvement in liver and intestinal inflammatory networks. World J Gastroenterol 2014;20:22-30.
►38 Santangelo L, Marchetti A, Cicchini C, Conigliaro A, Conti B, Mancone C, Bonzo JA, Gonzalez FJ, Alonzi T, Amicone L, Tripodi M: The stable repression of mesenchymal program is required for hepatocyte identity: a novel role for hepatocyte nuclear factor 4alpha. Hepatology 2011;53:2063-2074.
►39 Sugano M, Nagasaka T, Sasaki E, Murakami Y, Hosoda W, Hida T, Mitsudomi T, Yatabe Y: HNF4alpha as a marker for invasive mucinous adenocarcinoma of the lung. Am J Surg Pathol 2013;37:211-218.
►40 Koyama T, Sekine S, Taniguchi H, Tsuda H, Ikegami M, Hano H, Kushima R: Hepatocyte nuclear factor 4A expression discriminates gastric involvement by metastatic breast carcinomas from primary gastric adenocarcinomas. Hum Pathol 2011;42:1777-1784.
►41 Park JH, Lee NK, Lee SY: Current Understanding of RANK Signaling in Osteoclast Differentiation and Maturation. Mol Cells 2017;40:706-713.
►42 Andersen TL, del Carmen Ovejero M, Kirkegaard T, Lenhard T, Foged NT, Delaisse JM: A scrutiny of matrix metalloproteinases in osteoclasts: evidence for heterogeneity and for the presence of MMPs synthesized by other cells. Bone 2004;35:1107-1119.
►43 Boyle WJ, Simonet WS, Lacey DL: Osteoclast differentiation and activation. Nature 2003;423:337-342.
►44 Bi H, Chen X, Gao S, Yu X, Xiao J, Zhang B, Liu X, Dai M: Key Triggers of Osteoclast-Related Diseases and Available Strategies for Targeted Therapies: A Review. Front Med (Lausanne) 2017;4:234.
►45 Deng X, He G, Liu J, Luo F, Peng X, Tang S, Gao Z, Lin Q, Keller JM, Yang T, Keller ET: Recent advances in bone- targeted therapies of metastatic prostate cancer. Cancer Treat Rev 2014;40:730-738.
►46 Hofbauer LC, Lacey DL, Dunstan CR, Spelsberg TC, Riggs BL, Khosla S: Interleukin-lbeta and tumor necrosis factor-alpha, but not interleukin-6, stimulate osteoprotegerin ligand gene expression in human osteoblastic cells. Bone 1999;25:255-259.
►47 Mundy GR: Osteoporosis and inflammation. Nutr Rev 2007;65:S147-151.