Положительное иммуностимулирующее действие хлореллы при кратковременном приеме: повышение активности естественных киллеров и ранний воспалительный ответ (Рандомизированное двойное слепое плацебо-контролируемое исследование)
Аннотация
Справка: Исследования in vitro и исследования на животных показали, что хлорелла является мощным модификатором биологического ответа по отношению к иммунитету. Однако прямых доказательств влияния добавок хлореллы на иммунный/воспалительный ответ у здоровых людей нет.
Методы: Данный анализ основан на 8-недельном рандомизированном двойном слепом плацебо-контролируемом исследовании: 5 г хлореллы (n=23) или плацебо (n=28) в форме таблеток. Преимущественно были зафиксированы цитотоксическая активность естественных киллеров (NK-клеток) и концентрации сывороточного интерферона-γ, интерлейкина-1β и интерлейкина-12.
Результаты: Спустя 8 недель концентрации сывороточного интерферона-γ (p<0,05) и интерлейкина-1β (p<0,001) значительно возросли, а концентрация интерлейкина-12 (p<0,1) в целом выросла в группе, принимавшей хлореллу. Рост этих цитокинов после начала приема препаратов значительно увеличился в группе хлореллы по сравнению с плацебо-группой. Кроме этого, в группе с хлореллой значительно возросла активность NK-клеток (%), но не в плацебо-группе. Более значительный рост активности NK-клеток (%) также наблюдался среди добровольцев, принимавших хлореллу. Изменение активности NK-клеток также оказало положительное влияние на работу сывороточного интерлейкина-1β (r=0,280, p=0,047) и интерферона-γ (r=0,271, p<0,005). Тесная положительная взаимосвязь была также отмечена при изменении сывороточных уровней цитокинов, между интерфероном-γ и интерлейкином-1β (r=0,448, p<0001), между интерлейкином-12 и интерлейкином-1β (r=0,416, p=0,003) и между интерлейкином-12 и интерфероном-γ (r=0,570, p<001).
Заключение: Эти результаты позволяют предположить положительное иммуностимулирующее действие хлореллы при кратковременном приеме, которое повышает активность NK-клеток и запускает производство интерферона-γ и интерлейкина-12, а также интерлейкин-1β и цитокины, индуцированные клетками Th-1, у здоровых людей.
Ключевые слова: Хлорелла, активность естественных киллеров, интерлейкин-12, интерферон-γ, интерлейкин-1β, иммуностимулирующее действие.
Справка
Хлорелла представляет собой одноклеточную зеленую водоросль, которая содержит незаменимые аминокислоты, белки, минералы, витамины, пищевые волокна, а также большое разнообразие антиоксидантов, биоактивных компонентов, хлорофилла и т. д. [1,2].Она является популярным продуктом питания по всему миру, в особенности в странах Азии, например, Японии и Корее.
Хлорелла продемонстрировала фармакологическое действие не только в ходе экспериментов на моделях животных [3,4], но и во время исследований с участием добровольцев [5-7]. По словам Окудо и др. [>5], уровень холестерина в крови пациентов с гиперхолестеринемией, принимавших хлореллу, снизился. Фудживара и др. [6] также говорят о полезном влиянии хлореллы на гиперлипемию. Накамура и др. продемонстрировали, что прием хлореллы снижает кровяное давление у людей с умеренной гипертонией [7]. Дополнительный прием хлореллы в течение 6 недель оказывает благотворное влияние на антиоксидантный статус курящих мужчин [8]. Помимо этого, хлорелла показала значительный антиоксидантный эффект и снизила уровень глюкозы в крови у моделей животных с диабетом и мышей с язвой, вызванной стрессом [9-15].
На самом деле, исследования in vitro и эксперименты на животных показали, что хлорелла или экстракт хлореллы участвуют в модуляции иммунных ответов на опухоли [16-18], бактериальные и вирусные инфекции [19-23], а также нативные антигены, т. е. казеин [24]. Сообщается, что пероральный прием экстракта хлореллы повышает устойчивость к инфекции, вызванной Listeria monocytogenes, внутриклеточной бактерией, путем усиления ответа клеток T-хелперов 1 (Th1) как у здоровых хозяев, так и у хозяев с иммунодефицитом [21,22]. Однако прямых свидетельств, доказывающих влияние добавок хлореллы на иммунные реакции у человека, в частности у здорового неинфицированного человека, нет. По этой причине это исследование направлено на изучение того, оказывает ли хлорелла положительное иммуностимулирующее действие на здоровых неинфицированных людей.
Материалы и методы
Участники исследования
Участники исследования были выбраны из Центра медицинского обслуживания больницы Ёнсе. Участники исключались, если в их истории болезни присутствуют следующие заболевания или состояния: 1) клинические или электрокардиографические признаки ишемической болезни сердца, инсульт, инфаркт миокарда или окклюзионное заболевание периферических артерий; 2) сахарный диабет (глюкоза натощак ≥126 мг/дл или уровень глюкозы в сыворотке через 2 часа ≥200 мг/дл после перорального глюкозотолерантного теста с 75 г. глюкозы; 3) нарушение функции печени или почек; 4) заболевание щитовидной железы или гипофиза; 5) острое или хроническое воспалительное/иммунное заболевание, включая злокачественную опухоль, заболевание легких, лейкемию, аутоиммунное заболевание; 6) непереносимость лактозы, 7) ортопедические ограничения; 8) потеря/увеличение массы тела ≥10% за последний 1 год; 9) регулярное употребление любых лекарств, которые могут повлиять на метаболизм и работу сердечно-сосудистой системы и 10) количество лейкоцитов >8×103/мкл. Цель исследования была подробно объяснена добровольцам, было получено их письменное информированное согласие, а протокол одобрен Этическим комитетом Университета Ёнсе. Наконец, для участия в исследовании было отобрано 60 человек.
Разработка исследования и источник хлореллы
Данный анализ разработан на основе 8-недельного рандомизированного двойного слепого плацебо-контролируемого исследования. Шестьдесят участников были случайным образом распределены в две группы, получавших плацебо (n = 30) или 5 г хлореллы (n = 30) в форме таблеток. Таблетки для исследования содержали только сухую хлореллу (чистота 97%), полученную из 100% Chlorella vulgaris (CVE) (Daesang Corp., Сеул, Южная Корея), в качестве активного ингредиента, а идентичные таблетки с плацебо содержали лактозу. Участники принимали в сутки 5 г хлореллы (12 таблеток в сутки) или плацебо (12 таблеток в сутки) по 4 таблетки после каждого основного приема пищи. Все добровольцы продолжали вести привычный образ жизни и питаться как обычно. Выполнение инструкций оценивалось подсчетом оставшихся таблеток и изучением дневника питания. Успешность выполнения инструкций более чем на 80% считалась удовлетворительной.
Антропометрические показатели и сбор крови
Вес тела и рост измерялись по утрам без одежды и обуви. Индекс массы тела (ИМТ) рассчитывался как вес тела в килограммах, деленный на квадрат роста в метрах (кг/м2). Кровяное давление (АД) измерялось на левой руке сидящего пациента с помощью автоматического прибора для измерения давления (TM-2654, A&D, Токио, Япония) после 20 минут отдыха. После ночного голодания (12 часов) в простые и обработанные ЭДТА пробирки были собраны образцы венозной крови. Пробирки были сразу же помещены в лед до момента поступления в лабораторию (в течение 1-3 часов). Образцы крови в ЭДТА-пробирках были использованы для выделения мононуклеарных клеток периферической крови ((PBMC), из крови в простых пробирках была получена сыворотка, которая хранилась при температуре -70°C до анализа.
Выделение мононуклеарных клеток периферической крови (PBMC)
Кровь была смешана с таким же объемом RPMI 1640 (Gibco, Invitrogen Co, США) и аккуратно помещена в центрифугу Histopaque-1077(Sigma, Калифорния, США) на 2000 об/мин на 20 минут при температуре 10°C. После выделения стал различим тонкий слой клеток PBMC, которые были дважды промыты с помощью RPMI 1640 и ресуспендированы в RPMI 1640 со стрептомицином. Они были использованы для оценки цитотоксичности естественных киллеров (NK-клеток).
Цитотоксическая активность естественных киллеров (NK-клеток).
Цитолитическая активность NK-клеток была определена с помощью набора CytoTox 96W Non-Radioactive Cytotoxicity Assay Kit (Promega Co., Висконсин, США). Для цитотоксической активности NK-клеток РВМС, выделенные у каждого участника, инкубировали с клетками К562. Говоря кратко, клетки РВМС (эффекторные клетки, Е) были посеяны в лунку с клетками К562 в соотношении 5:1 и 1,25:1 (2×104 клетки/лунка) (клетки-мишени, Т). Планшеты, обработанные Е:Т в различном соотношении (5:1 и 1,25:1), инкубировали при температуре 37°С с 5% СО2 в течение ночи в соответствии с инструкциями производителя. Наконец, активность NK-клеток эффекторных клеток была измерена с помощью многофункционального анализатора 2030 (Victor™ x5, PerkinElmer, США) при 490 нм и была рассчитана по данной формуле.
% Цитотоксичность
Эффекторный — Экспериментальный спонтанный — Таргетный спонтанный
Таргетный максимальныйгетный спонтанный
×100
Оценка цитокинов для сывороточных концентраций интерферона-γ, интерлейкина-1β
и интерлейкина-12
Сывороточные концентрации интерферона-γ (ИФН-γ), интерлейкина-1β (ИЛ-1β) и интерлейкина-12 (ИЛ-12) были измерены с использованием набора Bio-Plex Pro™ Assay kit (Bio-Rad Laboratories, Inc., Геркулес, Калифорния, США) согласно инструкциям производителя.
Липидный профиль сыворотки и количество лейкоцитов
Уровни общего холестерина и триглицеридов (ТГ) в сыворотке крови натощак измеряли с использованием доступных в продаже наборов для анализатора Hitachi 7150 (Hitachi Ltd. Токио, Япония). После осаждения хиломикронов сыворотки, липопротеинов низкой плотности (ЛПНП) и липопротеинов очень низкой плотности (ЛПОНП) с помощью декстрансульфата магния, холестерин ЛПВП (ХС ЛПВП), оставшийся в супернатанте, измеряли ферментативным методом. Холестерин ЛПНП (ХС ЛПНП) был оценен косвенно с использованием формулы Фридвальда для участников с концентрацией ТГ в сыворотке <400 мг/дл (4,52 моль/л). У участников с концентрацией ТГ в сыворотке ≥400 мг/дл (4,52 моль/л) ХС ЛПНП измеряли ферментативным методом непосредственно на анализаторе Hitachi 7150. Количество лейкоцитов (WBC) определяли с помощью анализатора HORIBA ABX (HORIBA ABX SAS, ParcEuromedicine, Франция).
Оценка рациона питания и уровня физической активности
Информация о привычном рационе питания добровольцев была собрана с помощью метода 24-часового воспроизведения и полуколичественного вопросника частоты приема пищи (SQFFQ), достоверность которого была проверена ранее. Первый метод мы использовали для проведения анализов, а второй для проверки соответствия полученных данных обычному режиму питания. Все участники исследования получали письменные и устные инструкции от зарегистрированного врача-диетолога по завершению 3-дневного (2 рабочих дня и 1 выходной) учета питания каждые 4 недели. Энергия и питательные вещества из пищи, потребляемой в течение трех дней, были рассчитаны с помощью аналитической программы Computer Aided Nutritional analysis program (CAN-pro 2.0, Korean Nutrition Society, Сеул, Корея). Общее количество необходимых калорий (TEE) (ккал/день) было рассчитано на основе показателей активности, в том числе скорости обмена веществ, физической активности в течение 24 часов [26] и специфического динамического действия пищи. Базальная скорость метаболизма каждого добровольца рассчитывалась с помощью формулы Харриса-Бенедикта [27].
Статистический анализ
Статистический анализ был проведен с использованием SPSS версии 15.0 для Windows (Статистический пакет для социальных наук, SPSS Inc., Чикаго, Иллинойс, США). Для тестов внутри группы мы проводили парные t-тесты. Для межгруппового анализа был использован t-критерий Стьюдента для сравнения начальных значений или абсолютных (чистых) различий. Частоты среди групп были проверены критерием хи-квадрат. Коэффициенты корреляции Пирсона использовались для изучения взаимосвязей между переменными. Мы определили, была ли каждая переменная правильно распределена перед статистическим тестированием, а для искаженных переменных выполнено логарифмическое преобразование. Средние значения представлены в описательных целях с использованием непреобразованных значений. Результаты выражены как среднее значение±стандартная ошибка или %. Двузначное значение p<0,05 считалось статистически значимым.
Результаты
Среди участников исследования (n=60) 9 добровольцев выбыли, а 51 закончили исследование. Среди 9 выбывших, 7 были из плацебо-группы (2 по личным причинам, 5 в результате неудовлетворительного выполнения инструкций) и 2 из группы, принимавшей хлореллу (по личным причинам). Не было отмечено каких-либо побочных реакций в результате приема хлореллы и выполнении инструкции на 85% процентов и выше. Участники получали по 360 таблеток плацебо или хлореллы на неделях 0 и 4 соответственно. В следующий визит они должны были принести оставшиеся таблетки (недели 4 и 8 соответственно). Во время звонка каждые 2 недели в период вмешательства диетолог настоятельно рекомендовал всем добровольцам регулярно употреблять таблетки.
Общие и биохимические характеристики участников исследования
Таблица 1 демонстрирует общие и биохимические параметры, зафиксированные в начале и после 8 недели приема хлореллы. Распределение по полу и возрасту между двумя группами значительно не отличалось. Не отмечено значительной разницы между двумя группами исходных и измененных значений индекса массы тела, количества лейкоцитов (WBC), артериального давления, соотношения талии и бедер (СТБ) и липидного профиля (Таблица 1). Кроме этого, между группами нет значительной разницы в количестве потребляемых продуктов и расходе энергии (Таблица 2).
Таблица 1 Общая характеристика объектов исследования до и после 8-недельного вмешательства
Хлорелла (n = 28) Плацебо ( n = 23)
|
|
Неделя 0 |
Неделя 8 |
|
Неделя 0 |
Неделя 8 |
|
Муж/Жен (n) |
10/18 |
10/13 |
|||
|
Возраст (год) |
36.3 ± 1.82 |
32.6 ± 1.77 |
|||
|
Вес(кг) ИМТ(кг/м2) |
62.7 ± 1.89 22.8 ± 0.53 |
62.4 ± 1.86 22.7 ± 0.51 |
63.6 ± 2.63 22.7 ± 0.72 |
63.0 ± 2.56 22.5 ± 0.69 |
|
|
Систолическое АД (мм. рт. ст) |
114.5 ± 3.29 |
114.1 ± 2.44 |
118.12 ± 2.52 |
117.8 ± 2.18 |
|
|
Диастолическое АД (мм. рт. ст) WBC (х103/мкл) |
77.2 ± 2.32 4.72 ± 0.16 |
77.2 ± 1.74 4.96 ± 0.14 |
82.0 ± 2.07 5.03 ± 0.17 |
79.0 ± 2.15 5.21 ± 0.21 |
|
|
Триглицериды (мг/дл) |
104.0 ± 11.79 |
114.6 ± 13.0 |
129.2 ± 24.2 |
120.4 ± 19.5 |
|
|
Холестерин общий (мг/дл) |
183.0 ± 6.42 |
177.5 ± 5.20 |
181.3 ± 6.65 |
178.7 ± 5.81 |
|
|
ХС ЛПВП (мг/дл) |
48.1 ± 2.75 |
48.6 ± 3.27 |
49.1 ± 2.64 |
51.3 ± 2.76 |
|
|
ХС ЛПНП (мг/дл) |
114.1 ± 6.76 |
106.0 ± 4.86 |
106.6 ± 5.46 |
101.7 ± 4.06 |
Среднее ± стандартная ошибка или частота.
Проверено с помощью парного t-критерия (внутригрупповое сравнение) и независимого t-критерия (межгрупповое сравнение для исходного значения). Ни при внутригрупповом, ни при межгрупповом сравнении не отмечено значительных отличий.
ИМТ: индекс массы тела, АД: артериальное давление, WBC: лейкоциты.
Концентрация цитокинов в сыворотке до и после вмешательства
Рисунок 1 показывает сывороточные концентрации ИФН-γ, ИЛ-1β и ИЛ-12 между группой, принимавшей хлореллу, и плацебо-группой до и после вмешательства. Исходные уровни цитокинов в обеих группах существенно не отличались. После периода вмешательства сывороточные концентрации ИФН-γ (p<0,05) и ИЛ-1β (p<0,001) в группе с хлореллой значительно выросли. Более того, разница в значениях ИФН-γ (p<0,001), ИЛ-1β (p <0,01) и ИЛ-12 (p<0,01) между группами до и после вмешательства оказалась значительной.
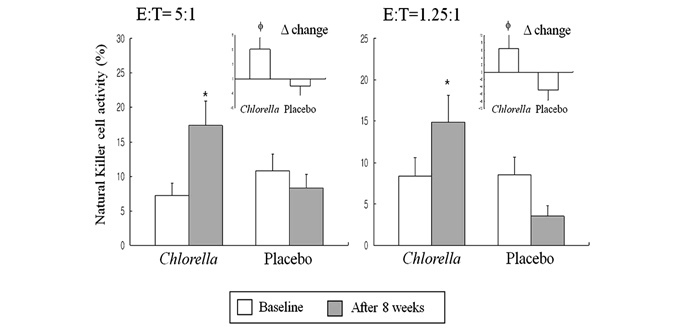
Активность естественных киллеров
Активность естественных киллеров (NK-клеток) (%) оценивалась исходя из отношения эффекторных клеток (Е) (PBMC) каждого участника исследования к клеткам-мишеням (Т) (К562 клетки) как 5:1 или 1,25:1. Как показано на Рисунке 2, активность NK-клеток в обоих случаях (E:T=5:1 и 1,25:1) значительно выросла 8 недель спустя в группе, принимавшей хлореллу (p <0,05, p<0,05 соответственно). В плацебо-группе активность, по-видимому снизилась, однако это значение не является статистически значимым. Кроме того были отмечены значительные различия в разнице значений в группе с хлореллой, но не в плацебо-группе (E:T=5:1, p<0,05 и E:T=1,25:1, p<0,05 соответственно).
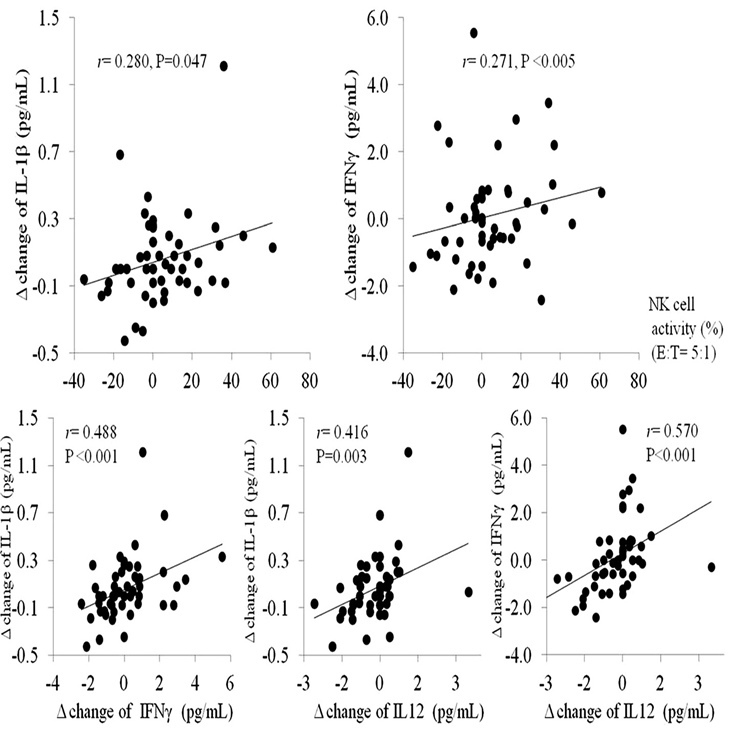
Взаимосвязь между измененными значениями ИЛ-12, ИФН-γ и ИЛ-1β в сыворотке
и активность NK-клеток
Как показано на Рисунке 3, изменения в активности NK-клеток (%) (E:T=5:1) были положительно связаны с активность сывороточных ИЛ-1β (r=0,280, p=0,047) и ИФН- γ (r=0,271, p<0,005).
Таблица 2 Ежедневное потребление пищи и расход энергии среди корейцев до и после 8-недельного вмешательства
|
|
|
Хлорелла ( n = 28) |
|
|
|
Плацебо ( n = 23) |
|
|
Неделя 0 |
|
Неделя 8 |
|
Неделя 0 |
|
Неделя 8 |
|
|
TEE (ккал) |
2323 ± 64.5 |
2348 ± 60.2 |
2424 ± 85.0 |
2470 ± 82.7 |
|||
|
Оценка питательных веществ, употребляемых ежедневно |
|||||||
|
TCI (ккал/день) |
2284 ± 47.2 |
2288 ± 50.5 |
2221 ± 93.6 |
2187 ± 96.2 |
|||
|
TEE/TCI |
1.02 ± 0.02 |
1.03 ± 0.02 |
1.13 ± 0.07 |
1.17 ± 0.06 |
|||
|
Углеводы (%) |
61.6 ± 0.15 |
61.6 ± 0.17 |
61.6 ± 0.23 |
61.7 ± 0.24 |
|||
|
Белки (%) |
16.7 ± 0.17 |
16.8 ± 0.15 |
16.3 ± 0.17 |
16.6 ± 0.21 |
|||
|
Жиры (%) |
22.0 ± 0.18 |
16.3 ± 0.17 |
22.3 ± 0.23 |
22.0 ± 0.26 |
|||
|
Клетчатка |
22.6 ± 1.38 |
22.3 ±1.31 |
21.8 ± 1.60 |
22.4 ± 1.89 |
Среднее ± стандартная ошибка.
Проверено с помощью парного t-критерия (внутригрупповое сравнение) и независимого t-критерия (межгрупповое сравнение для исходного значения). Ни при внутригрупповом, ни при межгрупповом сравнении не отмечено значительных отличий.
TEE: общее количество необходимых калорий; TCI: общее количество потребляемых калорий.

Тесная положительная взаимосвязь была также отмечена при изменении сывороточных уровней цитокинов, между ИФН-γ и ИЛ-1β (r=0,48, p<0,01), между ИЛ-12 и ИЛ-1β (r=0,416, p=0,003) и между ИЛ-12 и ИФН-γ (r=0,570, p<001).
Обсуждение
Настоящее исследование показывает, что дополнительный прием хлореллы в форме таблеток в течение 8 недель может оказывать положительное иммуностимулирующее действие на здоровых (неинфицированный) людей путем повышения активности NK-клеток и производства ИФН-γ и ИЛ-12, а также ИЛ-1β, цитокинов, индуцированных Th-1 клетками.
Т-хелперы (Th) разделены на два функциональных подкласса, лимфоциты Th-1 и Th-2, основываясь на цитокинах, которые они производят и действия на гуморальный и клеточный иммунитет[28]. Клетки Th-1 производят ИЛ-2, ИФН-γ, ФНО-α и ИЛ-12, а также повышают клеточный иммунитет, ингибируя таким образом клеточную иммунологическую активность. С другой стороны, клетки Th-2 производят ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10 и усиливают гуморальный иммунитет.
Полученные из Th-1 и Th-2 цитокины также регулировали друг друга при различных клинических условиях. Хазегава и др. сообщили, что на модели мышей, инфицированных Listeria monocytogenes, экстракт хлореллы (из Chlorella vulgaris, CVE) увеличивает выработку ИЛ-12 и ИФН-γ [29], которые способствуют дифференцировке наивных CD4+ Т-лимфоцитов в клетки Th-1, продуцирующие ИФН-γ, но подавляют образование клеток Th-2, продуцирующих ИЛ-4. В другом его сообщении пероральный прием CVE мышами ингибировал выработку иммуноглобулина E (IgE) по сравнению с казеином и нарушением ответа Th-2 [11]. Эварт и др. показали, что экстракт хлореллы (из Chlorella pyrenoidosa, CPE) индуцирует цитокиновый ответ по типу Th-1 (ИФН-γ и ФНО-α) и сильный противовоспалительную реакцию регуляторных цитокинов (ИЛ-10) в клетках человека РВМС, стимулированных ex vivo [30]. В нашем исследовании у добровольцев, принимавших таблетки хлореллы в течение 8 недель, наблюдалось значительное повышение уровня ИФН-γ в сыворотке крови и тенденция к повышению уровня ИЛ-12 по сравнению с участниками, которые принимал плацебо, что указывает на то, что прием хлореллы может вызывать производство ИФН-γ и ИЛ-12, способствующих опосредованной иммунной реакции Th-1 у людей.
Мы также обнаружили повышенные уровни сывороточного ИЛ-1β, который является частью семьи цитокинов ИЛ-1 и продуцируется активированными макрофагами [31]. Этот цитокин является важным медиатором воспалительной реакции и участвует в различных клеточных процессах, включая пролиферацию, дифференцировку и апоптоз клеток [31]. ИЛ-1β стимулирует различные клетки выступать в роли эффекторных клеток иммунного или воспалительного ответа. Хантер и его коллеги [32] отметили, что моделям мышей с тяжелым комбинированным иммунодефицитом необходим ИЛ-1β для того, чтобы ИЛ-12 стимулировал производство ИФН-γ NK-клетками [32]. По словам Томинаги и др. [33], ИЛ-12 и ИЛ-1β синергически индуцируют Т-клетки к пролиферации и производству Т-клеток, стимулированных ИФН-γ и ИЛ-12, которые реагируют на ИЛ-18 или ИЛ-1β своей пролиферацией и производством ИФН-γ. Однако количество ответов, индуцированных ИЛ-1β, было ниже. Наш результат может частично соответствовать отчету Ишикавы и др., показывающему, что богатая полисахаридами фракция Chlorella pyrenoidosa индуцировала ИЛ-1β и ФНО-α в клетках макрофагов [34]. В совокупности клетки хлореллы, вероятно, содержат иммуностимулирующую основу, которая стимулируют ответ на основе Th-1. Однако мы не измеряли цитокины, полученные из Th-2, такие как ИЛ-4 или ИЛ-6, поэтому нам может потребоваться подтвердить эти цитокины в дальнейших исследованиях.
В нашем исследовании у добровольцев, потреблявших хлореллу, наблюдалось значительное увеличение активности естественных киллеров (NK-клеток). Этот результат может частично соответствовать отчету Дантаса и др., показывающему, что пероральный прием экстракта хлореллы (CVE) значительно увеличивает активность NK-клеток у здоровых (неинфицированных) мышей, а также у мышей, инфицированных Listeria monqtogenes [35]. Кроме того, у животных, получавших CV, наблюдалось дозозависимое увеличение выживаемости. NK-клетки были впервые идентифицированы по их цитотоксической активности в отношении опухолевых клеток, что предполагает их влияние на иммунологический контроль неоплазии. Новые данные показали, что NK-клетки являются важными медиаторами врожденной устойчивости к различным патогенным внутриклеточным микроорганизмам [36]. Их основной функцией является производство раннего ИФН-γ, который имеет решающее значение для активации противомикробной функции макрофагов [37-42]. Кинетика производства ИФН-γ NK-клетками после инфекции чрезвычайно быстрая, что обеспечивает источник функционального цитокина в критический момент экспансии Т-клеток [39,43,44]. В нашем исследовании измененный после вмешательства уровень активности NK-клеток демонстрирует значительную положительную взаимосвязь с уровнем сывороточного ИФН-γ. Тесная положительная корреляция также наблюдалась среди измененных уровней ИФН-γ, ИЛ-12 и ИЛ-1β, цитокинов Th-1.
Возможно, в будущем нам придется рассмотреть возможность дальнейшего изучения с увеличением
количества участников и срока исследования, чтобы подтвердить и уточнить закономерность результата. Как показано на рисунках, сывороточные уровни ИФН-γ и ИЛ-12 значительно снизились в плацебо-группе через 8 недель, даже несмотря на то, что изменения этих цитокинов были значительно более разительны в группе хлореллы. Мы попытались найти факторы, которые могли повлиять на снижение этих показателей в группе плацебо, но кратко объяснить причину не просто. Во-первых, мы думали, что лактоза, содержащаяся в плацебо, может влиять на уровни цитокинов, но оказалось, что это не так. Во-вторых, не было существенной разницы в исходных значениях обеих групп, а значения изменений в целом были намного выше в группе хлореллы, даже несмотря на то, что направление увеличения или уменьшения не было различно между двумя группами. Однако взаимосвязь между активностью NK-клеток и цитокинами была всегда положительной, что может говорить о надежности измерений и полученных результатов.
Заключение
Это исследование было целенаправленно проведено с участием здоровых (неинфицированных) корейцев, поэтому результаты не стоит относить к пациентам других этнических или географических групп, чьи биохимические характеристики могут отличаться от показателей участников данного исследования. Несмотря на эти ограничения, прием хлореллы в течение 8 недель здоровыми корейцами повысил активность NK-клеток и способствовал производству ИФН-γ и ИЛ-12, а также ИЛ-1β, цитокинов, индуцированных Th-1. Кроме этого, изменение активности NK-клеток положительно коррелировало с естественными киллерами в цитокинах после вмешательства. Эти результаты дополняют информацию, присутствующую в литературе о положительном иммуностимулирующем действии хлореллы в клинических исследованиях с участием человека.
Сокращения
ИМТ: Индекс массы тела; АД: Артериальное давление; Е: Эффекторные клетки; ИФН: Интерферон; ИЛ: Интерлейкин; ХС ЛПВП: Холестерин липопротеин высокой плотности; ХС ЛПНП: Холестерин липопротеин низкой плотности; NK-клетки: Естественные киллеры; PBMC: Мононуклеарные клетки периферической крови; Т: Клетки-мишени; ТЕЕ: Общее количество необходимых калорий;
WBC: Лейкоциты.
Конкурирующие интересы
У авторов исследования нет конфликта интересов в отношении материалов, представленных в данной статье.
Участие авторов
Все авторы принимали участие в разработке протокола исследования и плана эксперимента. Все авторы ознакомились, прокомментировали и внесли свой вклад в представленную рукопись. Сбор образцов и эксперименты были проведены Ч.Х.К., С.Х.Б., Ё.В., Д.К.Х., Б.Г.К. И О.Ё.К. Данные были проанализированы Ч.Х.К., С.Х.Б. и О.Ё.К. Рукопись была написана и отредактирована О.Ё.К. и Ч.Х.Л. О.Ё.К. и Ч.Х.Л. представили результаты исследования. Все авторы прочитали и одобрили окончательный вариант рукописи.
Благодарность и финансовая поддержка
Мы благодарим добровольцев, участвовавших в исследовании, описанном в данной рукописи. Проведение исследования поддерживали Национальный исследовательский фонд, Министерство образование, науки и технологии (Программа для исследователей среднего звена: 2012-0005604 и 2012-0001851), Корейский проект исследований и разработок в области технологий здравоохранения, Министерство здравоохранения и социального обеспечения, Южная Корея (A050376) и Daesang.Co.Ltd, Южная Корея.
Сведения об авторах
1Научно-исследовательский институт старения Университета Йонсей, Университет Ёнсе, Сеул, Южная Корея.
2Факультет биологии, Колледж наук о жизни и биотехнологии, Университет Ёнсе, Сеул, Южная Корея.
3Междисциплинарный курс науки о старении, аспирантура, Университет Ёнсе, Сеул, Южная Корея.
4Daesang.Co.Ltd, Кёнгидо, Южная Корея.
5Факультет пищевых наук и питания Колледж экологии человека, Университет Донг-А, Пусан, Южная Корея.
6Факультет пищевых наук и питания Колледж экологии человека, Университет Ёнсе, 134 Shinchon-dong, Sudaemun-Gu, Сеулl 120-749, Южная Корея.
Получено: 15 мая 2012 Принято: 17 июля 2012
Опубликовано: 31 июля 2012
Библиографический список
- Borowitzka MA: Vitamins and fine chemicals from
micro-algae. In Micro-algal biotechnology. Edited by Borowitzka LJ. New York: Cambridge University Press; 1988:153.
- Schubert LE: The use of spirulina and chlorella as food resource for animals and humans. In Progressing physiological research. Edited by Round FE, Chapman DJ. Bristol, U.K: Biopress Ltd; 1988:23.
- Morita K, Matsueda T, Lida T, Hasegawa T: Chlorella accelerates dioxin excretion in rats. J Nutr 1999, 129:1731–1736.
- Morita K, Ogata K, Hasegawa T: Chlorophyll derived from Chlorella inhibits dioxin absorption from the gastrointestinal tract and accelerates dioxin excretion in rats. Environ Health Perspect 2001, 109:289–294.
- Okudo M, Hasegawa T, Sonoda M, Okabe T, Tanaka M: The effects of Chlorella on the level of cholesterol in serum and liver. Jpn J Nutr 1975, 33:3–8.
- Fujiwara Y, Hirakawa K, Sinpo K: Effect of long-term administration of Chlorella tablets on hyperlipemia. J Jpn Soc Nutr Food Sci 1990, 43:167–173.
- Nakamura T, Hasegawa T, Ueno S, et al: Effect of g-aminobutyric acid-rich Chlorella on blood pressure in mildly hypertensive subjects. Jpn Pharmacol Ther 2000, 28:529–533.
- Lee SH, Kang HJ, Lee HJ, Kang MH, Park YK: Six-week supplementation with Chlorella has favorable impact on antioxidant status in Korean male smokers. Nutrition 2010, 26:175–183.
- Queiroz ML, Bincoletto C, Valadares MC, Dantas DC, Santos LM: Effects of Chlorella vulgaris extract on cytokines production in Listeria monocytogenes infected mice. Immunopharmacol Immunotoxicol 2002, 24:483–496.
- Hasegawa T, Matsuguchi T, Noda K, Tanaka K, Kumamoto S, Shoyama Y, Yoshikai Y: Toll-like receptor 2 is at least partly involved in the antitumor activity of glycoprotein from Chlorella vulgaris. Int Immunopharmacol 2002, 2:579–589.
- Tanaka K, Yamada A, Noda K, Hasegawa T, Okuda K, Shoyama Y, Nomoto K: A novel glycoprotein obtained from Chlorella vulgaris strain CK22 shows antimetastatic immunopotentiation. Cancer Immunol Immunother 1998, 45:313–320.
- Shibata S, Natori Y, Nishihara T, Tomisaka K, Matsubara K, Sanawa H, Nguyen VC: Antioxidant and anticataract effect of Chlorella on rats with streptozotocin-induced diabetes. J Nutr Sci Vitaminol 2003, 49:334–339.
- Rodriguez-Lopez M, Lopez-Quijada C: Plasma glucose and plasma insulin in normal and alloxanized rats treated with Chlorella. Life Sci 1971, 10:57–68.
- Lee HS, Choi CY, Cho C, Song Y: Attenuating effect of chlorella supplementation on oxidative stress and NF kappa B activation in peritoneal macrophages and liver of C57BL/6 mice fed on an atherogenic diet. BiosciBiotechnol Biochem 2003, 67:2083–2090.
- Tanaka K, Yamada A, Nada K, Shoyama Y, Kubo C, Nomoto K: Oral administration of a unicellular green algae, Chlorella vulgaris, prevents stress-induced ulcer. Plant Med 1997, 63:465–466.
- Tanaka K, Konishi F, Himeno K, Taniguchi K, Nomoto K: Augmentation of antitumor resistance by a strain of unicellular green algae, Chlorella vulgaris. Cancer Immunol Immunother 1984, 17:90–94.
- Konishi F, Tanaka K, Himeno K, Taniguchi K, Nomoto K: Antitumor effect induced by a hot water extract of Chlorella vulgaris (CE): resistance to Meth-A tumor growth mediated by CE-induced polymorphonuclear leukocytes. Cancer Immunol Immunother 1985, 19:73–78.
- Tanaka K, Tomita Y, Tsuruta M, et al: Oral administration of Chlorella vulgaris augments concomitant antitumor immunity. Immunopharmacol Immunotoxicol 1990, 12:277-21.
- Tanaka K, Koga T, Konishi F: Augmentation of host defense by a unicellular green alga, Chlorella vulgaris, to Escherichia coli infection. Infect Immun 1986, 53:267–271.
- Hasegawa T, Tanaka K, Ueno K: Augmentation of the resistance against Escherichia coli by oral administration of a hot water extract of Chlorella vulgaris in rats. Int J Immunopharmacol 1989, 11:971–976.
- Hasegawa T, Okuda M, Nomoto K, Yoshikai Y: Augmentation of the resistance against Listeria monocytogenes by oral administration of a hot water extract of Chlorella vulgaris in mice. Immunopharmacol Immunotoxicol 1994, 16:191–202.
- Hasegawa T, Okuda M, Makino M, Hiromatsu K, Nomoto K, Yoshikai Y: Hot water extracts of Chlorella vulgaris reduce opportunistic infection with Listeria monocytogenes in C57BL/6 mice infected with LP-BM5 murine leukemia viruses. Int J Immunopharmacol 1995, 17:505–512.
- Ibusuki K, Minamishima Y: Effect of Chlorella vulgaris extracts on murine cytomegalovirus infections. Nat Immun Cell Growth Regul 1990, 9:121–128.Shim JS, Oh KW, Suh I, Kim MY, Shon CY, Lee EJ, Nam CM: A study on validity of a 299 semiquantitative food frequency questionnaire of Korean adults. Kor J Community Nutr 2002, 7:484–494.
- Christian JL, Greger JL: Nutrition for Living. Redwood City, CA: Benjamin/ Cummings; 1994:111.
- The American Dietetic Association: Handbook of clinical dietetics. 2nd edition. New Haven, CT: Yale University Press; 1992:5–39.
- Nair MP, Kandaswami C, Mahajan S, et al: The flavonoid, quercetin, differentially regulates Th-1 (IFNgamma) and Th-2 (IL4) cytokine gene expression by normal peripheral blood mononuclear cells. BiochimBiophys Acta 2002, 1593:29–36.
- Hasegawa T, Kimura Y, Hiromatsu K, et al: Effect of hot water extract of Chlorella vulgaris on cytokine expression patterns in mice with murine acquired immunodeficiency syndrome after infection with Listeria monocytogenes. Immunopharmacology 1997, 35:273–282.
- Ewart HS, Bloch O, Girouard GS, et al: Stimulation of cytokine production in human peripheral blood mononuclear cells by an aqueous Chlorella extract. Planta Med 2007, 73:762–768.
- Cheng FC, Lin A, Feng JJ, Mizoguchi T, Takekoshi H, Kubota H, Kato Y, Naoki Y: Effects of Chlorella on Activities of Protein Tyrosine Phosphatases, Matrix Metalloproteinases, Caspases, Cytokine Release, B and T Cell Proliferations, and Phorbol Ester Receptor Binding. J Med Food 2004, 7:146–152.
- Hunter CA, Chizzonite R, Remington JS: IL-1 beta is required for IL-12 to induce production of IFN-gamma by NK cells. A role for IL-1 beta in the T cell-independent mechanism of resistance against intracellular pathogens. J Immunol 1995, 155:4347–4354.
- Tominaga K, Yoshimoto T, Torigoe K, Kurimoto M, Matsui K, Hada T, Okamura H, Nakanishi K: IL-12 synergizes with IL-18 or IL-1beta for IFN- gamma production from human T cells. Int Immunol 2000, 12:151–160.
- Ishikawa Y, Sugiyama H, Stylianou E, Kitamura M: Bioflavonoid quercetin inhibits interleukin-1-induced transcriptional expression of monocyte chemoattractant protein-1 in glomerular cells via suppression of nuclear factor-kappaB. J Am Soc Nephrol 1999, 10:2290–2296.
- Dantas DC, Kaneno R, Queiroz ML: The effects of Chlorella vulgaris in the protection of mice infected with Listeria monocytogenes: Role of natural killer cells. Immunopharmacol Immunotoxicol 1999, 21:609–619.
- Brombacher F, Kopf M: Innate versus acquired immunity in listeriosis. Res Immunol 1996, 147:505–551.
- Teixeira HC, Kaufmann SHE: Role of NKl.1' cells in experimental listeriosis. NK1+ cells are early IFN-gamma producers but impair resistance to Listeria monocytogenes infection. J Immunol 1994, 152:1873–1882.
- Dunn PL, North RJ: Early gamma interferon production by natural killer cells is important in defense against murine listeriosis. Infect Immunity 1991, 59:2892–2900.
- Bancroft GJ: The role of natural killer cells in innate resistance to infection. Curr OF Immunol 1993, 5:503–510.
- Kaufmann SHE: Immunity to intracellular bacteria. Annu Rev Immunol 1993,
11:129–163.
- Denis M: Interferon-gamma-treated murine macrophages inhibit growth of tubercle bacilli via the generation of reactive nitrogen intermediates. Cell Immunol 1991, 132:150–157.
- Nathan CF, Murray HW, Wiebe MB, Rubin BY: Identification of interferon- gamma as the lymphokine that activates human macrophage oxidative metabolism and antimicrobial activity. J Exp Med 1983, 158:670–689.
- Bancroft GJ, Schreiber RD, Bosma GC, Bosma MJ, Unanue ER: A T cell independent mechanism of macrophage activation by interferon gamma. J Immunol 1987, 139:1104–1107.
- Bancroft GJ, Schreiber RD, Unanue ER: Natural immunity: A T-cell independent pathway of macrophage activation defined in the scid mouse. Immunol Rev 1991, 124:5–24.