Производные артемизинина инактивируют ассоциированные с раком фибробласты путем подавления передачи сигналов трансформирующего ростового фактора бета при раке молочной железы
Юйюань Яо (YYY)1†, Цинлун Го (QG)1†, Юэ Цао (YC)1, Янминь Цю (YMQ)1, Жэньсян Тань (RXT)2, Чжоу Юй (ZY)1, Юйсинь Чжоу (YЧZ)1 и На Лю (NL)1*
Аннотация
Исходные положения:
Опухоль-ассоциированные фибробласты(ФАО) представляют собой активированные фибробласты, связанные с раком. Они играют важную роль в росте опухоли и ее метастазировании. Артемизинин (ART) представляет собой сесквитерпеновый лактон, извлеченный из китайского растения цинхао (полынь однолетняя), а артеметер (ARM), артесунат (ARS) и дигидроартемизинин (DHA) являлись синтезированными производными артемизинина, которые также обладают противомалярийным и противораковым действием, как и артемизинин.Методы: В этом исследовании мы изучили in vitro и in vivo воздействия производных артемизинина на инактивацию опухоль-ассоциированных фибробластов и раскрыли лежащий в их основе механизм.
Результаты: Мы продемонстрировали, что ARS и DHA могут обращать L-929-CAF и CAF из активированного в инактивированное состояние в условиях in vitro. ARS и DHA способны механически подавлять сигнал TGF-β, ингибируя активацию L-929-CAF и CAF, а также снижать взаимодействие между опухолью и опухолевым микроокружением. Результаты показали, что ARS и DHA могут подавлять CAF-индуцированный рост рака молочной железы и метастазирование в ортотопической модели. Соответственно, ARS и DHA подавляли сигнал TGF-β, в результате чего происходила инактивация опухоль-ассоциированныхфибробластови ингибирование метастазирования in vivo. Выводы: Производные артемизинина являются потенциальными лекарственными препаратами для лечения рака молочной железы.
Ключевые слова: CAF, TGF-β 1, ART, ARM, ARS, DHA
Исходные положения
Рак молочной железы является распространенным раком у женщин и остается основной причиной смерти, связанной с раком, в западных странах из-за отсутствия эффективных методов лечения [1]. Опухолевый процесс имеет сложную структуру, включающую в себя активацию прорастания и метастазирования, индуцирование ангиогенеза, избегание иммунной деструкции и т. д. [2, 3]. Эти особенности определяют собой взаимодействие между различными клеточными и внеклеточными элементами опухолей, которые известны как микроокружение опухоли (МОО) Опухолевое микроокружение составляют опухоль-ассоциированныефибробласты(CAF), иммунные и воспалительные клетки, эндотелиальные клетки, клетка костномозгового происхождения, капилляры, базальная мембрана и внеклеточный матрикс (ЭКМ), окружающие раковые клетки [3, 4].
С конца XIX века в области изучения фибробластов произошло значительное развитие. Фибробласты, ассоциированные с раком, активируются; их называют опухоль-ассоциированными фибробластами (ФАО). Активированные фибробласты могут приобретать дальнейшие секреторные фенотипы, особую способность ремоделирования внеклеточного матрикса, аутокринную активацию и функции динамического иммуномодулирующего сигнала. Этот процесс связан с непрерывным повреждающим воздействием, таким как развитие раковых поражений [5, 6].
Трансформирующий фактор роста-β (TGF-β), тромбоцитарный фактор роста (PDGF), фактор некроза опухоли (TNF), стромально-клеточный фактор 1 (SDF1) и фактор роста фибробластов 2 (FGF2) являются ключевыми медиаторами активации фибробластов в развитии рака. TGF-β может рекрутировать и активировать фибробласты при многих видах рака. Пролиферация и инвазия локальных раковых клеток и CAF стимулируются TGF-β, присутствующим в микроокружении опухоли [5, 6]. [5, 6]. Путь TGF-β представляет собой парадигму передачи сигналов от мембраны к ядру путем рецепторно-опосредованной активации транскрипционных факторов [7, 8]. Трансформирующий ростовой фактор бета 1 (TGF-β1) относится к семейству
плейотропных лигандов, которое в присутствии рецепторов серин/треонинкиназ образует гетеромерные комплексы, состоящие из двух лиганд-связывающих рецепторов (TGF-βRII) и двух рекрутированных рецепторов (TGF-ΒRI). При участии лиганда, TGF-ΒRII трансфосфорилирует и активирует киназную активность TGF-ΒRI, что приводит к фосфорилированию и мобилизации эффекторов транскрипции против SMAD-белков [9, 10]. [9, 10]. Действуя через ось SMAD-2/3, TGF-β1 управляет экспрессией ключевых генов ЭКМ, которые являются важнейшими компонентами формирующейся фиброзной ткани, включая коллагены, фибронектин и PAI-1. TGF-β1 концентрируется в накапливающем ЭКМ, тем самым усугубляя фиброзный ответ [11].
Артемизинин (ART) — химическое вещество, выделенное из сладкой полыни (циньхао, Artemisia annua L., Asteraceae) в 1972 году Юю Ту в Китайской академии традиционной китайской медицины [12, 13]. Уникальная химическая структура артемизинина представляет собой сесквитерпеновый лактон с мощной противомалярийной активностью. В последние годы путем введения новых групп в исходную структуру артемизинина был синтезирован ряд производных артемизинина, которые, как оказалось, обладают лучшей биологической активностью или растворимостью, включая артеметер (ARM), артесунат (ARS) и дигидроартемизинин (DHA). Артемизинин и его производные в настоящее время считаются наиболее эффективным препаратом при лечении церебральной малярии и хлорохин-резистентной Р.falciparum-малярии [14, 15]. Исследования, проведенные за последние два десятилетия, предоставили важную информацию о противораковой активности артемизинина и его производных, что указывает на возможность использовать этот класс соединений как эффективное средство лечения рака [16, 17].
Однако механизм действия ART, ARM, ARS и DHA в ингибировании метастазирования рака оставался неясным, и до сих пор неизвестно, уменьшала ли инактивация ФАО прогрессирование рака и метастазирование. В настоящем исследовании мы оценили влияние артемизинина и его производных на инактивацию опухоль-ассоциированныхфибробластов. Результаты показали, что ARS и DHA возвращают ФАО из активированного в инактивированное состояние путем подавления пути TGF-β, а также ингибируют рост раковой опухоли и ее метастазирование. Это позволило предположить, что инактивация ФАО артемизинином и его производными приводит к снижению взаимодействия между опухолью и ее ВКМ и, возможно, в перспективе может обеспечить стратегию для лечения рака молочной железы.
Материалы и методы
Реагенты
Диметилсульфоксид (ДМСО) был приобретен у компании "Сигма-Альдрих" ("Мерк", Дармштадт, Германия). В ДМСО, используемом в качестве базового раствора (0,1 М), растворили артемизинин (ART, 98% чистота, "Аладдин", Шанхай, Китай), артеметер (ARM, 98% чистота, "Аладдин", Шанхай, Китай), артесунат (ARS, 98% чистота, "Аладдин", Шанхай, Китай), и дигидроартемизинин (DHA, > 98% чистота, "Аладдин", Шанхай, Китай), полученный раствор хранили при -20°С и разбавляли средой DMEM (СредаИгла,модифицированная по способу Дульбекко) ("Гибко", Гранд-Айленд, Нью-Йорк) перед началом каждого эксперимента в рамках исследования in vitro. Натриевая карбоксилметилцеллюлоза (CMC-Na) была приобретена у компании "Синофарм Кемикал Реаджент Ко., Лтд." (Шанхай, Китай). ART, ARM, ARS и DHA были подготовлены в форме для внутрижелудочного введения (0,5% карбоксиметилцеллюлоза-Na) в исследовании in vivo.
Набор для подсчета клеток CCK-8 и набор для обнаружения апоптоза TUNEL FITC были приобретены у компании "Вазим" ("Вазим", Нанкин, Китай). Раствор "Аккумакс" был приобретен у компании "Сигма-Альдрих" ("Мерк", Дармштадт, Германия). Набор для иммуноферментного анализа мышиного TGF-бета-1 был поставлен "Эй.Би.Клонал" ("Эй.Би.Клонал", Ухань, Китай). Комплект для окраски пикросириусом красным предоставлен компанией "Йесен" ("Йесен", Шанхай, Китай). Первичные антитела против Ki67 поставлялись компанией "Селл Сигналинг Текнолоджи" (CST, Массачусетс, США), антитела против MMP-9, MMP-2, MMP-14, FAP, фибронектина, виментина, α-SMA, S100A4, p-Smad3 (Ser423/425), Smad3, TGF-β1 и ГАФДГ были поставлены "Эй.Би.Клонал" ("Эй.Би.Клонал", Ухань, Китай). IgG (H + L) пероксидазы хрена козьи антимышиные и IgG (H + L) пероксидазы хрена козьи антикроличьи были поставлены "Эй.Би.Клонал" ("Эй.Би.Клонал", Ухань, Китай). Козье анти-кроличье IgG (H + L) кросс-адсорбированное вторичное антитело и средство, препятствующее выгоранию, ProLong™ Gold Antifade Mountant, с ДАПИ были приобретены у компании "Термо" ("Термо", Уалтхэм, США). Субстрат для вестерн-блоттинга High-sig ECL был поставлен компанией "Танон" ("Танон", Шанхай, Китай). Антитела, нейтрализующие TGF-β1, были поставлены компанией "Абкам плк." ("Абкам", Кембридж, Великобритания).
Животные
Шестинедельных самок голых мышей линии BALB/c поставляла компания "Бейджин Вайтал Ривер Лаборатори Энимал Текнолоджи Ко., Лтд." (Пекин, Китай). Мыши MMTV-PyMT поставлены Нанкинским Институтом биомедицинских исследований Нанкинского университета (Нанкин, Китай). Все животные содержались в свободной от патогенов среде (23 ±2°C, влажность 55 ±5%) в течение 12 ч светлого/12 ч темного цикла и получали пищу и воду по желанию в течение всего экспериментального периода. Проведение исследования на животных и эвтаназия проводились в строгом соответствии с рекомендациями руководства по уходу за лабораторными животными и их использованию Национального института здравоохранения. Протокол был одобрен Комитетом по этике экспериментов на животных Китайского фармацевтического университета.
Клеточная культура
Клетки 4 Т1 мышиной карциномы молочной железы и клетки мышиных фибробластов L-929 были любезно предоставлены Клеточным банком Китайской академии наук. Клетки культивировали в среде DMEM ("Гибко", Грэнд Айленд, Нью-Йорк), содержащей 10% фетальной бычьей сыворотки ("Гибко"), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина, во влажной атмосфере, содержащей 5% CO2 при 37 °C.
Кондиционированную среду (КС) составили из супернатанта 4 Т1-клеток, меченных люциферазой, и использовали КС в различных экспериментах
для кондиционированной культуры с клетками L-929. Клетки L-929 культивировали в СМ в течение 48 ч до достижения активации и основных характеристик опухоль-ассоциированныхфибробластов, а затем создавали кондиционированную культуральную модель L-929-ФАО.
Выделение опухоль-ассоциированных фибробластов
[18, 19]Опухоль-ассоциированные фибробласты (CAF) были выделены из опухолей молочной железы у мышей MMTV-PyMT. Свежие опухолевые ткани препарировали в стерильной среде и несколько раз промывали ФСБ (предварительно охлажденным до 4°C, содержащим 200 ед/мл пенициллина и 200 мкг/мл стрептомицина). Тканевую оболочку и некроз удаляли стерильными офтальмологическими ножницами и пинцетом. Оставшиеся ткани измельчали и обрабатывали 4 ч препаратом ACCUMAX в стерильной среде при 37°С. Одноклеточные суспензии готовили и культивировали в среде DMEM, содержащей 10% фетальной бычьей сыворотки, 100 ед/мл пенициллина и 100 мкг/мл стрептомицина, в стабильной среде, содержащей 5% CO2 при 37 °C. Через 24 ч неприлипшие клетки смывали, а прилипшие клетки культивировали в свежей среде. Среду меняли каждые 2-4 дня, пока пролиферация клеток не становилась очевидной.
Анализ жизнеспособности клеток
Для измерения влияния ART, ARM, ARS или DHA на жизнеспособность клеток был проведен анализ на основе подсчета клеток CCK-8. Клетки наносились с плотностью 5 х 103 клетки на лунку в 96-луночных пластинах. После 24-часового культивирования клетки подвергали воздействию ART, ARM, ARS или DHA в течение 24 ч в инкубаторе 5% CO2 при 37°C. L-929-ФАО обрабатывали 50 мкм ART, ARM, ARS или DHA, ФАО обрабатывали 30 мкм ART, ARM, ARS или DHA. Затем в среду добавляли раствор CCK-8 и инкубировали при 37°C еще 4 часа. Коэффициент поглощения измеряли при длине волны 450 нм.
Вестерн-блоттинг
Клетки собирали после предварительной обработки с применением ART, ARM, ARS или DHA в течение 24 ч. Вестерн-блоттинг выполнялся способом, описанным ранее [20]. Мембрану блокировали 3% ным обезжиренным молоком в ФСБT при 37°C в течение 1 ч и инкубировали с указанными антителами в течение ночи при 4°C, а затем с вторичным антителом IgG (H + L) пероксидазы хрена козьи антимышиные или IgG (H + L) пероксидазы хрена козьи антикроличьи в течение 1 ч при 37°C. Визуализация образцов проводилась с помощью субстрата для вестерн-блоттинга High-sig ECL ("Танон", Шанхай, Китай) и полностью автоматизированной системы хемилюминесцентного анализа изображения ("Танон", Шанхай, Китай).
Иммунофлуоресценция
Клетки подвергали воздействию ART, ARM, ARS или DHA в течение 24 ч в 5%-ном CO2-инкубаторе при 37°С, а затем дважды промывали ФСБ. L-929-ФАО обрабатывали 50 мкм ART, ARM, ARS или DHA, ФАО — 30 мкм ART, ARM, ARS или DHA. Клетки фиксировали 4% параформальдегидом в течение 30 мин, пермеабилизировали в течение 15 мин в 0,2% тритоне Х-100 на льду и блокировали 3% БСА в течение 2 ч. Затем клетки инкубировали с указанными антителами с вечера на утро при температуре 4°С. После трехкратного промывания ФСБ клетки подвергали воздействию козьих анти-кроличьих IgG (H + L) кросс-адсорбированных вторичных антител ("Термо", Уалтхэм, США) в течение 1 ч. Затем клетки отмывали в ФСБ три раза и окрашивали ProLong™ Gold Antifade Mountant с ДАПИ. В конце производилось фотографирование слайдов с помощью конфокального лазерного сканирующего микроскопа (Fluoview FV1000, "Олимпус", Токио, Япония).
Определение цитокинов методом твердофазного ИФА
Концентрацию цитокинов в супернатанте определяли с помощью набора для ИФА с мышиным TGF-beta 1 ("Эй.Би.Клонал", Ухань, Китай) в соответствии с рекомендациями производителя[21, 22]. Коэффициент поглощения измеряли при длине волны 450 нм.
Анализ направленной миграции клеток
Трансвелл-камеры (диаметр 12 мм, размер пор 8 мкм, "Миллипор", Биллерика, Массачуссетс) использовались для оценки хемотактической подвижности 4 Т1-клеток в раковой среде [22]. L-929-ФАО или ФАО инкубировали в 24-луночных пластинах, в нижний отсек добавляли 600 мкл среды, содержащей ART, ARM, ARS или DHA. L-929-ФАО обрабатывали 50 мкм ART, ARM, ARS или DHA, ФАО — 30 мкм ART, ARM, ARS или DHA. 4 Т1-клетки, меченные люциферазой, собирали в свободную от сыворотки среду в конечной концентрации 3 х 105 клеток/мл. Затем 400 мкл клеточной суспензии помещали в верхнюю камеру трансвелл-системы. После инкубации в течение 24 ч клетки с верхней поверхности удаляли, а клетки направленной миграции на нижней поверхности фиксировали 100% метанолом и окрашивали гематоксилином и эозином. Затем проводилась количественная оценка вручную и анализ трех случайно выбранных полей для каждой группы.
Анализ клеточного проникновения
Анализ клеточной инвазии проводили аналогично вышеописанному анализу направленной миграции клеток, за исключением того, что матригель ("Корнинг", штат Нью-Йорк, США), разбавленный бессывороточной средой (1:8), предварительно наносили на верхние камеры трансвелл-системы при 37 °C в течение 1 ч [21]. После 24-часовой инкубации инвазионные клетки фиксировали, окрашивали и проводили их подсчет под микроскопом.
Животное-модель
Ортотопические инъекции были выполнены в соответствии с предшествующим исследованием с незначительными изменениями [21, 23, 24]. 1×104/25 мкл 4 Т1 клеток, меченных люциферазой, или 1 × 104/25 мкл 4Т1-люциферазных клеток плюс 3×104/25 мкл клеток L-929 клеток суспендировали в 25 мкл матригеля на льду, а затем клеточную суспензию быстро вводили в
четвертое жировое тело молочных желез (MFP). За животным велось наблюдение в течение 30 минут, до полной нормализации его состояния. Через 28 дней мыши, которым вводили клетки 4T1, были отнесены к отрицательной контрольной группе (8 мышей в группе, введение 0,5% CMC-Na с частотой один раз в день); мыши, которым вводили 4 T1-люциферазные клетки плюс L-929 клетки, были случайным образом разделены на шесть групп (8 мышей в группе): контрольная группа (гаваж 0,5% CMC-Na с частотой один раз в день), паклитаксел-положительная группа (внутрибрюшинное введение 10 мг/кг паклитаксела с частотой один раз в два дня), группа, получавшая ART (доза 100 мг/кг ART один раз в день); группа, получавшая ARM (доза 100 мг/кг ARM, один раз в день); группа, получавшая ARS (доза 100 мг/кг ARS, один раз в день); группа, получавшая DHA (гаваж, 100 мг/кг DHA, один раз в день). Вес, ширина (W) и длина (L) опухоли измерялись в среднем раз в три дня. Объем опухоли (V) оценивался по формуле:V="1/2xLxW2. Через 28 дней у мышей-носителей опухоли проводили оптическую визуализацию для определения экспрессии люциферазы в мышиной модели с помощью системы биолюминесцентной визуализации IVIS Lumina, затем голых мышей умерщвляли, а опухолевые ксенотрансплантаты отделяли и измеряли. Висцеральные ткани, резецированные у мышей, были зафиксированы в формалине и прошли исследование с применением окраски гематоксилин-эозином.
Это исследование было одобрено в лаборатории с применением животных, свободных от специфических патогенов при Китайском фармацевтическом университете. Во всех экспериментах соблюдались этические принципы исследований на животных, находящихся в сознании, с одобрения местного Комитета по этике исследований на животных.
Иммуногистохимическое исследование
Экспрессию Ki67, α-SMA, виментина и TGF-β1" опухолевых тканей в модели голых мышей оценивали в соответствии с инструкциями производителя [25] с использованием набора для обнаружения SPlink ("Биотин-Стрептавидин Эйч. Ар. Пи. Детекшн Системз"). Все реактивы, использованные в экспериментах, были поставлены компанией "ЗедЭсДжиБи-Байо Ко.", Пекин, Китай. Наблюдение и снимок выполнялись с помощью оптического микроскопа.
TUNEL-анализ
Индукцию апоптоза в образце ткани анализировали с помощью TUNEL-анализа. Он был выполнен в соответствии с инструкциями, прилагаемыми в наборе для обнаружения апоптоза TUNEL FITC ("Вазим", Нанкин, Китай). Фотографирование слайдов производилось с помощью конфокального лазерного сканирующего микроскопа (Fluoview FV1000, "Олимпус", Токио, Япония).
Анализ окрашивания красным Сириусом
Срезы ткани окрашивали в соответствии с инструкциями производителя с использованием набора пикросириуса красного ("Йесен", Шанхай, Китай). Наблюдение и снимок выполнялись с помощью оптического микроскопа.
Статистический анализ
Данные были получены по крайней мере из трех независимых экспериментов, и все данные в разных экспериментальных группах были выражены как среднее значение ± креднеквадратичное отклонение. Сравнения проводились относительно группы с индуцированием кондиционированной средой или контрольной группы in vitro, с группой 4T1+L-929 сравнение выполнялось in vivo. Различия между группами проверялись с помощью одностороннего дисперсионного анализа (ANOVA) и post hoc-критерия Даннетта. Изменения объема опухоли с течением времени оценивались с использованием смешанной модели случайных эффектов. Показатели метастазирования оценивались на основе процентной доли животных, у которых развились метастазы. Статистическая значимость различий составила *p<0,05 и **p<0,01.
Результаты
ARS и DHA возвращали L-929-ФАО и ФАО из активированного в неактивное состояние
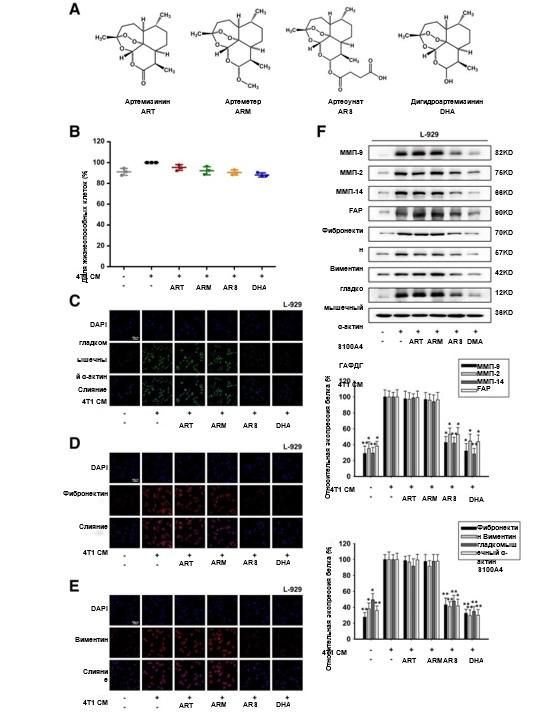
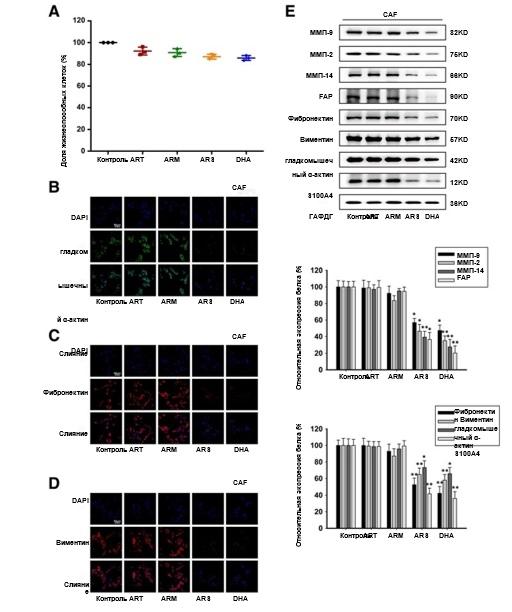
Химические структуры ART, ARM, ARS и DHA показаны на рис. 1a. Для исключения ингибирующего пролиферацию эффекта ART, ARM, ARS и DHA на L-929-ФАО и ФАО был проведен анализ с подсчетом клеток CCK-8. Как показано на рис. 1b и 2a, 50 мкМ или 30 мкМ ART, ARM, ARS или DHA не оказывают значительного влияния на жизнеспособность клеток L-929-ФАО и ФАО. Поэтому эти концентрации затем применялись ко всем последующим экспериментам in vitro.
ФАО были идентифицированы по морфологическим характеристикам и экспрессии специфических маркеров [26, 27]. [26, 27]. Для исследования воздействия CM-индуцированной культуральной модели использовали иммунофлуоресцентное окрашивание и вестерн-блоттинг для проверки экспрессии специфических маркеров, таких как ММП-9, ММП-2, ММП-14, FAP,, фибронектина, виментина, α-SMA и S100A4. Результаты показали, что эти белки были повышены при 4 Т1 CM, что позволило предположить, что 4 Т1 CM могут активировать клетки L-929 к L-929-ФАО в кондиционированной системе культур (рис. 1c-f). Как показано на Рис. 1c-f и 2b-e, обработка L-929-ФАО и ФАО препаратами ARS или DHA уменьшала экспрессию активационных белков, но ART и ARM не влияли на их экспрессию, что указывало на то, что ARS и DHA могут ингибировать активацию ФАО.
ARS и DHA подавляли путь TGF-β для ингибирования активации L-929-ФАО и ФАО
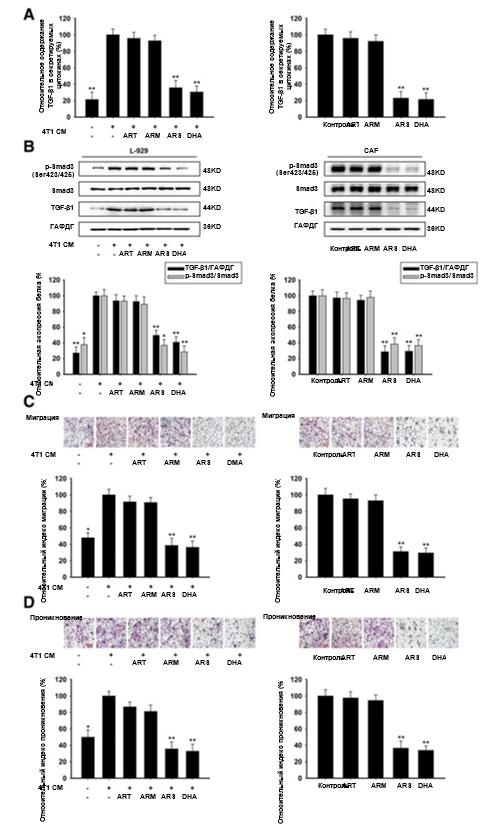
С помощью анализа ИФА и вестерн-блотинга мы обнаружили, что уровень секреции TGF-β1 в L-929-ФАО был повышен по сравнению с нормальными клетками L-929, а ARS и DHA могли снижать экспрессию белка p-Smad3 (Ser423/425) и TGF-β1 как в L-929-ФАО, так и в ФАО, но никаких существенных различий в группах ART и ARM не было обнаружено (рис. 3a и b). Вместе эти результаты позволили прийти к важному выводу о том, что ARS и DHA могут активировать ФАО через TGF-β1.
В предшествующих исследованиях отмечалась важность активированных фибробластов, которые могут способствовать развитию опухоли и
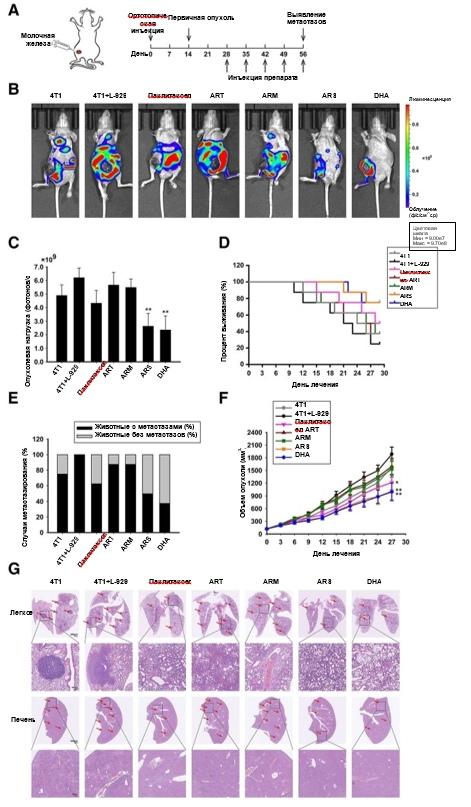
Рис. 1 ARS и DHA вернули L-929-ФАО из активированного в инактивированное состояние. L-929-ФАО подвергали воздействию 50 мкм ART, ARM, ARS или DHA в течение 24 ч. (a) Химическая структура ART, ARM, ARS и DHA. (b) Влияние ART, ARM, ARS и DHA на жизнеспособность клеток методом подсчета клеток CCK-8. (c-e) Для проверки влияния ART, ARM, ARS и DHA на связанные с ФАО биомаркерные белки было проведено иммунофлуоресцентное окрашивание α-SMA, фибронектина и виментина (увеличение изображения: 400x). (f) Экспрессия белков ММП-9, ММП-2, ММП-14, FAP, фибронектина, виментина, α-SMA и S100A4 в клетках анализировали методом вестерн-блоттинга с использованием специфических антител. Каждый эксперимент проводился не менее трех раз. Данные представлены в виде среднего значения ± среднее квадратичное отклонение. *p<0,05 по сравнению с группой с индуцированием кондиционированной средой; **p<0,01 по сравнению с группой с индуцированием кондиционированной средой;
Рис. 2. ARS и DHA возвращали ФАО из активированного в инактивированное состояние. CAF подвергали воздействию 30 мкМ ART, ARM, ARS или DHA в течение 24 ч. (a) Влияние ART, ARM, ARS и DHA на жизнеспособность клеток, определенная методом подсчета клеток CCK-8. (b-d) Для проверки влияния ART, ARM, ARS и DHA на связанные с ФАО биомаркерные белки было проведено иммунофлуоресцентное окрашивание α-SMA, фибронектина и виментина (увеличение изображения: 400x). (e) Экспрессия белков ММП-9, ММП-2, ММП-14, FAP, фибронектина, виментина, α-SMA и S100A4 в клетках анализировали методом вестерн-блоттинга с использованием специфических антител. Каждый эксперимент проводился не менее трех раз.Данные представлены в виде среднего значения ± среднее квадратичное отклонение.*p<0,05 в сравнении с контрольной группой;**p<0,01 в сравнении с контрольной группой
инвазия через их активный секретом, включая факторы роста и внеклеточный матрикс (ЭКМ) [6, 28]. Для оценки влияния артемизинина и его производных на миграцию и инвазию 4 Т1 клеток в присутствии ФАО применялся анализ направленной миграции клеток и анализ клеточной инвазии. Как показано на рис. 3с и d, L-929-ФАО может увеличить миграцию и инвазию 4 Т1-клеток в системе сокультуры. При применении ARS и DHA в отношении L-929-ФАО и ФАО лечили , миграция и инвазия 4 Т1-клеток резко снижались по сравнению с необработанными ФАО. Однако ART и ARM не способны были ингибировать миграцию и инвазию 4 Т1-клеток. Эти результаты показали, что стимулирующие функции ФАО в отношении миграции и инвазии подавлялись под действием ARS и DHA.
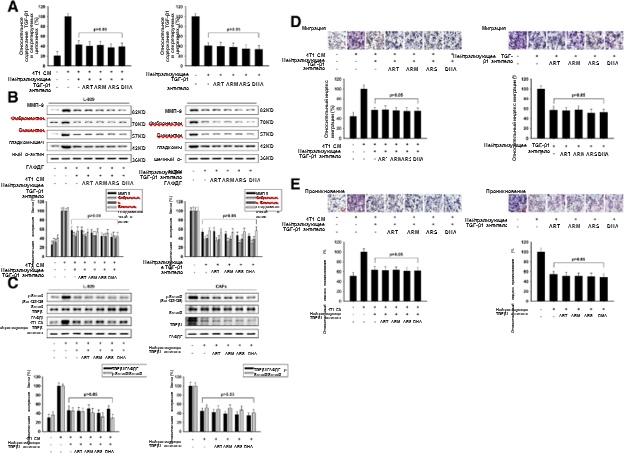
ARS и DHA не могли продолжать инактивировать L-929-ФАО и ФАО с нейтрализующим антителом TGF-β1
Чтобы подтвердить значимую роль TGF-β1 в кондиционированной культуре или системе ко-культуры, мы заблокировали взаимодействие TGF-β1 с помощью нейтрализующего TGF-β1
Рис. 3. ARS и DHA подавили TGF-β путь ингибирования активации L-929-ФАО и ФАО. L-929-ФАО и ФАО обрабатывались 50 мкМ или 30 мкМ ART, ARM, ARS или DHA, соответственно, в течение 24 часов. (a) влияние ART, ARM, ARS и DHA на содержание TGF-β1 в секретируемых цитокинах. (b) Экспрессию белков p-Smad3 (Ser423/425), Smad3 и TGF-β1 в клетках анализировали методом вестерн-блоттинга с использованием специфических антител. (c) способность к миграции оценивалась методом анализа направленной миграции клеток (увеличение изображения: 200x). (d) Инвазивную способность оценивали с помощью инвазионного анализа трансвелл с использованием матригелевого покрытия (увеличение изображения: 200x). Каждый эксперимент проводился не менее трех раз. Данные представлены в виде среднего значения ± среднее квадратичное отклонение. *p<0,05 по сравнению с группой с индуцированием кондиционированной средой или контрольной группой; **p<0,01 по сравнению с группой с индуцированием кондиционированной средой или контрольной группой
антитело. Как показано на 4A, 4B и 4C, анализ по методу твердофазного ИФА и анализ по методу вестерн-блоттинга доказали, что нейтрализующее антитело TGF-β1 может снижать экспрессию TGF-β1 и ингибировать активационный эффект ФАО. Артемизинин и его производные не могли далее снижать экспрессию специфических маркеров белка или подавлять путь TGF-β с помощью нейтрализующего антитела TGF-β1. Как показано на рис. 4d и e, присутствие нейтрализующего TGF-β1 антитела в системе ко-культуры снижало количество мигрировавших и инвазивных 4 Т1 клеток. Артемизинин и его производные не могли усилить эти ингибирующие воздействия, когда в систему ко-культуры добавляли нейтрализующее TGF-β1 антитело.
Рис. 4 ARS и DHA не могли продолжать инактивировать L-929-ФАО и ФАО с нейтрализующим антителом TGF-β1. L-929-ФАО и ФАО обрабатывали 50 мкм или 30 мкм ART, ARM, ARS или DHA в течение 24 ч соответственно. Нейтрализующее TGF-β1 антитело добавляли в культуральную систему для исчерпания секретируемого TGF-β1. (a) Влияние ART, ARM, ARS и DHA на содержание TGF-β1 в секретируемых цитокинах. (b) Экспрессию белков ММП-9, фибронектина, виментина и α-SMA в клетках анализировали методом вестерн-блоттинга с использованием специфических антител. (c) Экспрессию белков p-Smad3 (Ser423/425), Smad3 и TGF-β1 в клетках анализировали методом вестерн-блоттинга с использованием специфических антител. (d) Cпособность к миграции оценивалась методом анализа направленной миграции клеток (увеличение изображения: 200x). (e) Инвазивную способность оценивали с помощью инвазионного анализа трансвелл с использованием матригелевого покрытия (увеличение изображения: 200x). Каждый эксперимент проводился не менее трех раз. Данные представлены в виде среднего значения ± среднее квадратичное отклонение. *p<0,05 по сравнению с группой с индуцированием кондиционированной средой или контрольной группой; **p<0,01 по сравнению с группой с индуцированием кондиционированной средой или контрольной группой
Рис. 5ARS и DHA подавляли рост и метастазирование рака, индуцированного CAF, в условиях in vivo. (а) На диаграмме показан ход эксперимента на ортотопической модели (n=8). (b-c) Репрезентативные изображения и количественная оценка биолюминесценции опухолей молочной железы мышей, получавших паклитаксел (10 мг/кг), ART (100 мг/кг), ARM (100 мг/кг), ARS (100 мг/кг) и DHA (100 мг/кг). (d) Кривые выживаемости Каплана-Мейера для мышей-носителей опухоли молочной железы. (е) Вероятность метастазирования у мышей-носителей опухоли молочной железы. (f) Влияние паклитаксела (10 мг/кг), ART (100 мг/кг), ARM (100 мг/кг), ARS (100 мг/кг) и DHA (100 мг/кг) на рост опухоли исследовали в ортотопической модели. (g) Легкие и печень мышей с окраской гематоксилин-эозином для подтверждения присутствия микрометастазов. Каждый эксперимент проводился не менее трех раз. Данные представлены в виде среднего значения ± среднее квадратичное отклонение. *p<0,05 в сравнении с группой 4T1 +L-929; **p < 0,01 в сравнении с группой 4T1 + L-929
ARS и DHA подавляли рост и метастазирование рака, индуцированного CAF, в условиях in vivo.
Ортотопическая модель рака молочной железы была использована для определения способности ART, ARM, ARS и DHA влиять на CAF-индуцированную опухолевую нагрузку и метастатический эффект in vivo (Рис. 5а). Из данных на рис. 5b-g видно, что присутствие ФАО приводило к появлению более крупных опухолей, большему числу сигналов биолюминесценции и метастатических поражений, чем в случаях без инъекции ФАО. Как показано на рис. 5b и с, сигналы биолюминесценции после 28-дневной обработки были значительно снижены за счет действия ARS и DHA. ARS и DHA значительно увеличивали продолжительность жизни мышей-опухоленосителей по сравнению с другими группами (рис. 5d). Как видно из рис. 5е, вероятность метастазирования, индуцированного ФАО, была снижена ARS (50%) и DHA (37,5%), в то время как вероятность метастазирования паклитаксела, ART и ARM составила 62,5, 87,5 и 87,5%. Как показано на рис. 5f, во время 28-дневного применения ARS и DHA объем опухоли уменьшался более явно, чем при использовании паклитаксела, ART и ARM. В ортотопической модели раковые клетки могут метастазировать в несколько органов, включая мозг, легкие, печень и кости. Затем мы проанализировали метастазы в легких и печени на основе срезов патологических тканей. Результаты показали, что ARS и DHA могут подавлять образование метастазов в легких и печени (рис. 5g).
ARS и DHA инактивировали опухоль-ассоциированные фибробласты путем подавления передачи сигналов TGF-β in vivo
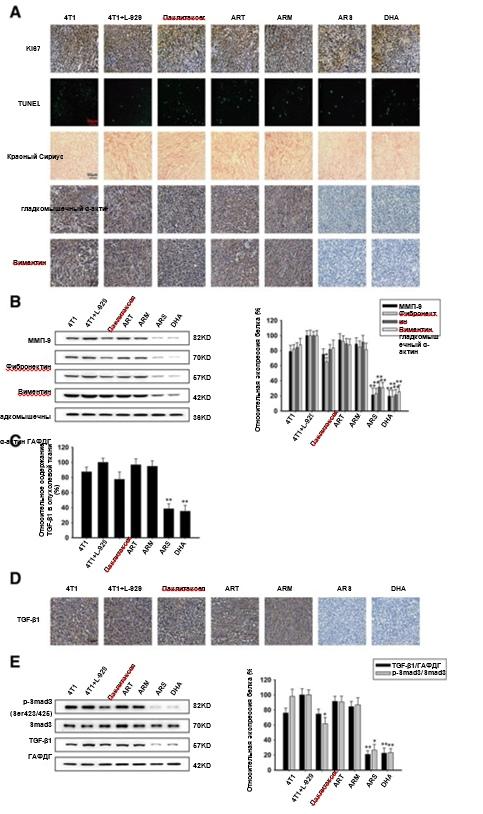
Как видно из рис. 6а, мы исследовали влияние ART, ARM, ARS и DHA на CAF-индуцированные ортотопические опухоли с помощью детекции Ki67 и анализа TUNEL. Доля Ki67-позитивных клеток в опухолевых тканях была снижена в незначительной степени после лечения паклитакселом, ART, ARM, ARS и DHA. Анализ TUNEL, проведенный для обнаружения апоптотических клеток в опухолевых тканях, показал, что ART, ARM, ARS и DHA не могут индуцировать повреждение ДНК опухолевых тканей. Таким образом, мы пришли к выводу, что ART, ARM, ARS и DHA не могут индуцировать апоптоз опухоли и ограниченное ингибирование клеточной пролиферации in vivo. Результаты анализа окрашивания "красным сириусом", иммуногистохимии и вестерн-блоттинга показали, что применение ARS и DHA снижает содержание коллагена в ткани и экспрессию специфических маркеров, таких как ММП-9, фибронектин, виментин и α-SMA (рис. 6а и b). Методом ИФА было обнаружено, что уровень секреции TGF-β1 в CAF-индуцированных опухолях был повышен по сравнению с теми, в которые инъекции ФАО не производились (рис. 6с). В то же время в ФАО-индуцированных опухолях экспрессия белка p-Smad3 (Ser423/425) и TGF-β1 также была повышена (рис. 6d и е). Как показано на рис. 6с, d и e, анализ ИФА, иммуногистохимический анализ и вестерн-блоттинг последовательно подтвердили, что ARS и DHA могут снижать экспрессию белка p-Smad3 (Ser423/425) и TGF-β1, но ART и ARM не оказывали никакого влияния на экспрессию белка.
Обсуждение
Артемизинин (ART) — это сесквитерпеновый лактон с 1,2,4-триоксановой кольцевой системой, экстрагированный из китайской травы цинхао. Для повышения эффективности и переносимости средства, на основе сесквитерпенового лактонного шаблона были разработаны три поколения артемизининоподобных полусинтетических и полностью синтетических эндопероксидных соединений, в том числе артеметер (ARM), артесунат (ARS) и дигидроартемизинин (DHA) [29]. Предшествующие исследования показали, что эффективные концентрации лекарств для воздействия на раковые клетки обычно выше, чем применяемые для уничтожения малярийных паразитов. Эндопероксидная составляющая структуры артемизинина обеспечивает его противомалярийные и противораковые эффекты. Восстановление гема или двухвалентного железа может активировать эндопероксидную связь и порождать цитотоксические углерод-центрированные радикалы. Однако отсутствие эндопероксидной части не отменяет противоопухолевую активность полностью, но значительно снижает цитотоксичность, что позволяет предположить, что противоопухолевая активность артемизинина и его производных может включать альтернативные механизмы [29-32]. В этом исследовании мы впервые продемонстрировали, что производные артемизинина могут инактивировать опухоль-ассоциированные фибробласты, подавляя рост рака и метастазирование при раке молочной железы.
Опухоль-ассоциированные фибробласты (ФАО) играют важную роль в росте опухоли и ее метастазировании, например стимулируют ангиогенез, клеточную пролиферацию, миграцию и инвазию. ФАО могут высвобождать факторы роста и цитокины, продуцировать металлопротеиназы (ММП) и понижающе регулировать CD36 [3, 33, 34]. ФАО может влиять на жесткость ЭКМ при первичных опухолях, усиливать миграцию и инвазию раковых клеток путем индукции эпителиально-мезенхимального перехода (EМП) [3, 35, 36]. Для идентификации ФАО используются специфические маркеры, такие как α-гладкомышечный актин (α-SMA),
Рис. 6 Инактивирование ФАО с помощью ARS и DHA через подавление TGF-β сигнала in vivo. (а) Окрашивание TUNEL, красным сириусом и иммуногистохимическое определение уровней белка Ki67, α-SMA и виментина на биомаркере ФАО на ортотопическом участке (увеличение изображения: 400x). (b) Экспрессия протеинов ММП-9, фибронектина, виментина и гладкомышечного α-актина анализировалась на ортотопическом участке с помощью вестерн-блоттинга с применением специфических антител. Антитела ГАФДГ использовались для определения нагрузки белковым эквивалентом. (c) Влияние Паклитаксела, ART, ARM, ARS и DHA на содержание TGF-β1 в опухолевой ткани. (d) Иммуногистохимическое определение уровней белка TGF-β1 на ортотопическом участке (увеличение изображения: 400x). (e) Экспрессию белков ofp-Smad3 (Ser423/425), Smad3 и TGF-β1 анализировали на ортотопическом участке методом вестерн-блоттинга с использованием специфических антител. Каждый эксперимент проводился не менее трех раз. Данные представлены в виде среднего значения ± среднее квадратичное отклонение. *p<0,05 в сравнении с группой 4T1+L-929;**p<0,01 в сравнении с группой 4T1+L-929
фибробластспецифический белок-1 (FSP1, также называемый S100A4), активирующий фибробласты белок (FAP), виментин, рецептор тромбоцитарного фактора роста-α (PDGFR-α), рецептор тромбоцитарного фактора роста-β (PDGFR-β), хондроитинсульфат протеогликан нейрон-глиальный антиген-2 (NG2) и так далее [26]. Поэтому для измерения влияния артемизинина и его производных на инактивацию L-929-ФАО и ФАО in vitro были использованы иммунофлуоресцентный анализ и вестерн-блоттинг. Мы обнаружили, что ARS и DHA могут снижать экспрессию специфических маркеров для ингибирования активации ФАО, что было важно для оценки инактивационных эффектов артемизинина и его производных.
TGF-β связывается с рецептором типа II на поверхности клетки, рекрутируя рецептор TGF-β типа I (TGF-βri). Активированный TGF-βri фосфорилирует COOH-концевые области Smad2 и Smad3, образуя комплекс с Smad4 с последующей транслокацией из цитоплазмы в ядро, регулируя экспрессию генов в клеточной пролиферации, дифференцировке, миграции и формировании ЭКМ. Также были оценены возможности анти-TGF-β-терапии в лечении рака, поскольку оно позволяет воздействовать на различные компоненты опухолевой среды [37-39]. Наше исследование показало, что ARS и DHA подавляют сигнализацию TGF-β в ФАО за счет снижения секреции TGF-β1. Кроме того, повышенная экспрессия TGF-β1 системой культуры, индуцированной CM, также была снижена под действием ARS и DHA. При обработке ФАО нейтрализующим TGF-β1 антителом воздействие артемизинина и его производных на специфические маркеры белка существенно не снижались, а ингибирование передачи сигналов TGF-β не усиливалось, что указывало на то, что инактивация ФАО под действием производных артемизинина может зависеть от экспрессии TGF-β1.
Если фибробласты экспрессировали активационный белок и секреторный белок в опухолевой среде, в результате превратившись в ФАО, то ФАО не могли вернуться в инактивированное состояние [6]. Следовательно, разработка препаратов, нацеленных на ФАО в стадии покоя, может быть привлекательной терапевтической стратегией, которая может нарушить перекрестный контакт опухоль/строма и ингибировать прогрессирование опухоли. Мы обнаружили, что, хотя ФАО могут индуцировать миграцию и инвазию 4 Т1-клеток, производные артемизинина также могут уменьшать миграцию и инвазию 4 Т1-клеток. Кроме того, производные артемизинина не могли вызывать более редуцирующих эффектов миграции и инвазии при добавлении в систему ко-культуры нейтрализующего антитела TGF-β1. Эти результаты показали, что производные артемизинина могут уменьшать перекрестные связи между ФАО и раковыми клетками, в результате ингибируя метастазирование опухоли.
Ортотопическая модель рака молочной железы у голых мышей BALB/c была использована для изучения влияния артемизинина и его производных на CAF-индуцированную опухолевую нагрузку и метастатический эффект in vivo. Учитывая, что пероральное введение препарата безопаснее и удобнее, мы применяли гаваж вместо внутривенной инъекции, чтобы уменьшить токсичность у голых мышей BALB/c. Мы наблюдали, что наличие CAF может индуцировать больший объем раковой опухоли и большее число метастатических поражений. Полученные результаты также подтвердили, что артемизинин и его производные подавляют сигнализацию TGF-β, снижая индуцированный ФАО рост рака и метастазирование in vivo.
В настоящем исследовании присутствовал ряд потенциальных методологических недостатков, таких как использование со-культур и ксенотрансплантационные модели мышей. Эти экспериментальные модели имеют фундаментальное значение для доклинических исследований рака, но между результатами этих экспериментов и результатами, полученными в клинических условиях, наблюдаются существенные расхождения [27]. Необходимо провести дальнейшие исследования, чтобы подтвердить эффективность производных артемизинина при раке в клинических исследованиях.
Выводы
В заключение следует отметить, что ARS и DHA могут подавлять сигнализацию TGF-β, тем самым инактивируя опухоль-ассоциированные фибробласты и, наконец, подавляя рост и метастазирование рака. Таким образом, производные артемизинина могут являться потенциальными лекарственными препаратами для лечения рака молочной железы.
Аббревиатуры
ARM: Артеметер; ARS: Артесунат; ART: артемизинин; Опухоль-ассоциированные фибробласты (ФАО); DHA: дигидроартемизинин; ЭКМ: внеклеточный матрикс;
EMT: эпителиально-мезенхимальный переход; FAP: белок активации фибробластов; FGF2: фактор роста фибробластов 2; FSP1 (S100A4): фибробласт-специфический белок-1; MFP: жировая подушка молочной железы; MMP: металлопротеиназы; NG2: хондроитин сульфат протеогликана нейрон-глиальных антигенов-2; PDGF: тромбоцитарный фактор роста; SDF1: стромальный клеточный фактор 1; TGF-β: трансформирующий фактор роста-β; МОО: микроокружение опухоли; ФНО: фактор некроза опухоли; TV: объем опухоли; α-SMA: гладкомышечный α-актин
Выражения признательности
Эта работа была выполнена при поддержке Национального фонда естественных наук Китая (№81830105, 81872899, 81703550, 81673461), Национальным фондом крупных научно-технических проектов (№ 2017ZX09101003-005-023, 2017ZX09101003-003-007,
2017ZX09301014), проектная программа Государственной лаборатории природных лекарственных средств, Китайский фармацевтический университет (SKLNMZZCX201823), Программа для ученых Чанцзяна и инновационной исследовательской группы Университета (IRT1193), проект Ключевой программы НИОКР провинции Цзянсу (социальное развитие) (BE2018711), открытый проект Государственной ключевой лабораторной базы совершенствования качества и эффективности традиционной китайской медицины, Нанкинский университет китайской медицины (№ TCMQ&E201704), Постдипломная научно-практическая инновационная программа провинции Цзянсу (№ 3152080070).
Финансирование
Не применимо.
Доступность данных и материалов
Все данные, полученные или проанализированные в ходе этого исследования, включены в настоящую опубликованную статью.
Вклад отдельных авторов
YYY, QLG и NL предложили провести настоящее исследование. YYY, YC и NL провели исследование и написали текст в предварительной редакции. YC, YMQ, RXT, ZY и YXZ проводили сбор и анализ данных. Все авторы внесли свой вклад в подготовку исследования и толкование его результатов, а также в подготовку последующих редакций. NL выступает в качестве гаранта. Все авторы прочитали и одобрили итоговый вариант рукописи.
Этическое одобрение и согласие на участие
Были соблюдены все применимые международные, национальные и/или институциональные руководящие принципы по уходу за животными и их использованию.
Согласие на публикацию
Не применимо.
Конфликт интересов
Заявляем об отсутствии конфликта интересов в связи с этой статьей. Все авторы участвовали в работе, одобрили рукопись и согласились с ее представлением в печать.
Примечание издателя
Журнал "Спрингер Нейчур" сохраняет нейтралитет в отношении юрисдикционных претензий по опубликованным картам и указаниям институциональной принадлежности.
Сведения об авторах
1Государственная лаборатория природных лекарственных средств, Ключевая лаборатория Цзянсу по канцерогенезу и методам лечения, факультет фундаментальной медицины и клинической фармации, Китайский фармацевтический университет, 24 Тунцзясян, 210009, г. Нанкин, Китайская Народная Республика. 2Государственная ключевая лабораторная база совершенствования качества и эффективности традиционной китайской медицины, Университет Китайской медицины в Нанкине, Синьлинь-роуд д. 138 Нанкин, 210023, Китайская Народная Республика.
Получено: 31 августа 2018 г. Принято: 13 ноября 2018 г.
Опубликовано онлайн: 26 ноября 2018 г.
Библиографический список
- Коста А., Киффер У., Шолер-Дахирел А., Пелон Ф., Бурашо Б., Кардон М., Сирвен П., Маганья И., Фурман Л., Бернард С. и др. Гетерогенность фибробластов и иммуносупрессивная среда при раке молочной железы у человека. Cancer Cell. 2018;33:463-79 e410.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-74.
- Белли К., Трапани Д., Виале Г., Д'Амико П., Дюзо Б. А., Делла Винья П., Орси Ф., Курильяно Дж. Таргетирование микроокружения в солидных опухолях. Cancer Treat Rev. 2018;65:22-32.
- Чжен Ф., Чжуан С., Лин Л., Йю П., Ванг Й., Ши Й., Ху Дж., Сун Й. Новые горизонты в биологии микроокружения опухоли: вызовы и возможности. BMC Med. 2015;13:45.
- Каллури Р., Цайсберг М. Фибробласты при раке. "Нейчур Ривьюз Кансер". 2006;6:392-401.
- Каллури Р. Биология и функции фибробластов при раке. "Нейчур Ривьюз Кансер". 2016;16:582-98.
- Ши Й., Массаг Дж. Механизмы передачи сигналов TGF-бета от клеточной мембраны к ядру. Cell. 2003;113:685-700.
- Дэвид С. Дж., Массаг Дж. Контекстуальные детерминанты действия TGF-бета в отношении развития, иммунитета и рака. Nat Rev Mol Cell Biol. 2018;19:419-35.
- Массаг Дж. Трансдукция сигнала TGF-бета. Annu Rev Biochem. 1998;67:753-91.
- Тан Дж., Гиффорд С. С.., Самаракун П., Хиггинс П. Дж. Дерегуляция негативного контроля над сигнализацией TGF-beta1 при прогрессировании опухоли. Cancers (Basel). 2018;10:1 -19.
- Уолтон К. Л., Джонсон К. Е., Харрисон К. А. Таргетирование TGF-бета-опосредованной SMAD-сигнализации для профилактики фиброза. "Фронтирз ин фармаколоджи", 2017;8:461.
- Ту Й. Открытие артемизинина (цинхао-су) и полезный опыт китайской медицины. Nat Med. 2011;17:1217-20.
- Ли Й. Цинхаосу (артемизинин): химия и фармакология. Acta Pharmacol Sin. 2012;33:1141 -6.
- Хоу Л., Хуан Х. Иммуносупрессивные свойства препаратов семейства артемизинина. Pharmacol Ther. 2016;166:123-7.
- Эфферт Т. От древних трав к современным лекарствам: Artemisia annua и артемизинин для лечения рака. Semin Cancer Biol. 2017;46:65-83.
- Эфферт Т. Комбинированная терапия рака препаратами артемизининового ряда. Biochem Pharmacol. 2017;139:56-70.
- Бау-Лаксимон А., Джхурри Д. Артемизинин и его производные в терапии рака: состояние прогресса, механизм действия и перспективы на будущее. Cancer Chemother Pharmacol. 2017;79:451 -66.
- Альба-Кастейон Л., Оливера-Сальгеро Р., Местре-Фаррера А., Пена Р., Херрера М., Бонилла Ф., Касал Дж. И., Баулида Дж., Пена К., Гарсиа де Херрерос А. Snail1-зависимая активация опухоль-ассоциированных фибробластов контролирует инвазию эпителиальных опухолевых клеток и метастазирование. Cancer Res. 2016;76:6205-17.
- Аллауи Р., Бергенфельц С., Мохлин С., Хагерлинг С., Салари К., Верб З., Андерсон Р.Л., Этьер С.П., Жирстром К., Палман С. и др. Опухоль-ассоциированный фибробласт CXCL16 привлекает моноциты для активации стромы при тройном отрицательном раке молочной железы. Nat Commun. 2016;7:13050.
- Лу З., Лу Н., Ли С Ли Ф., Чжао К., Лин Б., Гуо К. Ороксилин ингибирует экспрессию матричной металлопротеиназы-2/9 и активацию путем положительной регуляции тканевым ингибитором металлопротеиназы-2 и подавления сигнального пути ERK1/2. Toxicol Lett. 2012;209:211 -20.
- Йао Й., Чжао К., Йю Чж., Чжен Х., Чжао Л., Ли З., Гуо О., Лу Н. Вогоносид подавляет инвазию и миграцию за счет подавления экспрессии TRAF2 / 4 при раке молочной железы. J Exp Clin Cancer Res. 2017;36:103.
- Чжао К., Яо Й., Луо С., Линь Б., Хуан Y., Чжоу Й., Ли З., Гуо Ц., Лу Н. LYG-202 ингибирует активацию эндотелиальных клеток и ангиогенеза по пути CXCL12/CXCR7 при раке молочной железы. "Карсинодженезис". 2018;39:588-600.
- Чакрабарти Р., Канг И. Трансплантируемые мышиные модели опухолей метастазы рака молочной железы. Methods Mol Biol. 2015;1267:367-80.
- Луга В., Чжан Л., Вилория-Петит А.М., Огунджими А.А., Инанлу М.Р., Чиу Е., Бьюкенан М., Хосейн А.Н., Басик М., Врана Дж. Л. Экзосомы опосредуют стромальную мобилизацию аутокринной передачи сигналов Wnt-PCP при миграции клеток рака молочной железы. Cell. 2012;151:1542-56.
- Ван Х., Чжао Л., Чжу Л.Т., Ван Й., Пань Д., Яо Ц., Ю Ц. Л., Гуо Ц. Л. Вогонин преодолевает гипоксическую устойчивость клеток HCT116 рака толстой кишки человека путем понижения регуляции HIF-1 альфа и гликолиза, ингибируя сигнальный путь PI3K/Akt. Mol Carcinog. 2014;53(Suppl 1):E107-18.
- Гаскард П., Тлсти Т. Д. Опухоль-ассоциированные фибробласты: управление составом злокачественных опухолей. Genes Dev. 2016;30:1002-19.
- Валькенбург К. С., де Груут А. Е., Пента К. Дж. Таргетирование опухолевой стромы для улучшения терапии рака. Нейчур Ривью Клиникал Онколоджи. 2018;15:366-81.
- Дауэр П., Чжао Х., Гупта В.К., Шарма Н., Кеш К., Гнамлин П., Дуджа В., Виккерс С.М., Банерджи С., Салуджа А. Инактивация опухоль-ассоциированных фибробластов нарушает онкогенную сигнализацию в клетках рака поджелудочной железы и способствует регрессии. Cancer Res. 2018;78:1321 -33.
- Дас А. К. Противораковое действие противомалярийных артемизининовых соединений. Ann Med Health Sci Res. 2015;5:93-102.
- Мешник С.Р., Томас А., Ранц А., Сюй С.М., Пан Х.З. Артемизинин (цинхаосу): роль внутриклеточного гемина в его механизме противомалярийного действия. Mol Biochem Parasitol. 1991;49:181 -9.
- Беекман А. С., Виренга Р. К., Воерденбаг Х. Дж., Ван Уден В., Прас Н., Конингс А. В., эль-Ферали Ф. С., Галаль А. М., Виксторм Х. В. Артемизинин-производные сесквитерпеновые лактоны как потенциальные противоопухолевые соединения: цитотоксическое действие на костный мозг и опухолевые клетки. Planta Med. 1998;64:615-9.
- Оллиаро П. Л., Хайнес Р. К., Мейниер Б., Йутавон Й. Возможные режимы действия соединений типа артемизинина. Trends Parasitol. 2001;17:122-6.
- Прокопио М. Г., Лацло С., Аль Лаббан Д., Ким Д. Е., Бординьон П., Джо С.Х., Горуппи С., Мениетти Э., Остано П., Ала У. и др. Комбинированная понижающая регуляция CSL и p53 способствует активации опухоль-ассоциированных фибробластов. Nat Cell Biol. 2015;17: 1193-204.
- Ямаучи М., Баркер Т. Х., Гиббонс Д.Л., Кюри Д. М. Фиброзная опухолевая строма. J Clin Invest. 2018;128:16-25.
- Ю Й., Сяо С. Х., Тан Л. Д., Ван Ц. С., Ли С. Ц., Фен Й. М. Связанные с раком фибробласты индуцируют эпителиально-мезенхимальный переход клеток рака молочной железы посредством паракринной передачи сигналов TGF-бета. "Бритиш Джорнел оф Кансер". 2014;110:724-32.
- Ван С., Чжан В., Сунь С., Линь Й., Чень В. Опухоль-ассоциированные фибробласты индуцируют эпителиально-мезенхимальный переход через секретируемые цитокины в клетках рака эндометрия. Oncol Lett. 2018;15:5694-702.
- Навшад А., Лагамба Д., Полад А., Хэй Э. Д. Сигнализация трансформирующего фактора роста-бета во время эпителиально-мезенхимальной трансформации: последствия для эмбриогенеза и метастазов опухоли. Cells Tissues Organs. 2005;179:11 -23.
- Йошида К., Матсузаки К., Мурата М., Ямагучи Т., Сува К., Оказаки К. Клинико-патологическое значение передачи сигналов TGF-бета/фосфо-Smad при фиброканцерогенезе в печени человека. "Кансерз" (Базель). 2018;10:1 -17.
- Фурлер Р.Л., Никсон Д.Ф., Брантнер Ц.А., Попратилофф А., Уиттенбогаарт Ч. TGF-бета поддерживает прогрессирование опухоли через биохимическую и механическую трансдукцию сигнала. "Кансерз" (Базель). 2018;10:1 -18.